Kaj so politike, standardi in postopki. Uvedba pravil dobre lekarniške prakse, prakse shranjevanja in prevoza zdravil za medicinsko uporabo O potrditvi pravil dobre lekarniške prakse zdravil za medicinsko uporabo.
2. Duhovna sfera družbe. Problemi razvoja duhovne kulture v sodobni Rusiji.
Beseda "politika" izhaja iz grške besede politike, kar v prevodu v ruščino pomeni "državne zadeve", "umetnost vladanja".
Politika ni vedno obstajala. Med razlogi za njen nastanek so polarizacija družbe, nastanek družbenih nasprotij in konfliktov, ki jih je treba reševati, pa tudi povečana stopnja kompleksnosti in pomembnosti upravljanja družbe, ki je zahtevala oblikovanje posebnih organov, ločenih od ljudi. Pojav politične in državne oblasti je
najpomembnejši predpogoj za politiko.
Znanost ponuja različne definicije pojma »politika«:
1. Politika so odnosi med državami, razredi, družbenimi skupinami, narodi, ki nastanejo glede prevzema, izvajanja in zadrževanja politične oblasti v družbi, ter odnosi med državami v mednarodnem prostoru.
2. Politika je dejavnost državnih organov, političnih strank, javnih združenj na področju odnosov med družbenimi skupinami (razredi, narodi, države), katerih cilj je povezovanje njihovih prizadevanj z namenom krepitve ali pridobitve politične moči.
3. Politika je področje delovanja skupin, strank, posameznikov, države, povezanih z izvajanjem splošno pomembnih interesov s pomočjo politične moči.
Funkcije politike razumemo kot skupek procesov, ki izražajo njen namen v družbi. Med funkcijami politike so: a) izražanje pomembnih interesov vseh skupin in sektorjev družbe; b) povezovanje različnih družbenih slojev, ohranjanje celovitosti družbe; c) zagotavljanje nadaljnjega razvoja družbe; d) upravljanje in usmerjanje družbenih procesov, reševanje konfliktov in nasprotij; e) politična socializacija posameznika (t.j. proces posameznikove asimilacije družbenopolitičnih znanj, norm, vrednot in veščin dejavnosti).
oblast, zaradi česar prevzame določeno politično vlogo).
Po obsegu izvajanja ločimo lokalne, regionalne, državne in mednarodne politike, po času izvajanja pa tekoče, dolgoročne in dolgoročne.
Subjekti politike so posamezniki, družbene skupine, plasti, organizacije, ki so neposredno ali posredno vključeni v proces izvajanja politične oblasti ali vplivanja nanjo. Subjekti politike so lahko: a) družbene skupnosti (razredi, narodi itd.);
b) različne organizacije in združenja (države, stranke, gibanja, cerkve itd.); c) politične elite (privilegirane skupine, ki zasedajo vodilne položaje v vladnih strukturah in so neposredno vključene v vladno odločanje); d) posamezniki (vključno s političnimi voditelji). Stopnja in meje političnega delovanja političnih subjektov so odvisne od obstoječega političnega sistema v državi, ki določa meje in norme političnega delovanja; o socialni strukturi družbe, prisotnosti ali odsotnosti socialnih ovir (kvalifikacije, kaste, nacionalne, verske, razredne in druge omejitve);
o družbenem statusu določene plasti, osebnosti, družbene ustanove; od subjektivnih dejavnikov (osebne lastnosti osebe, število in vrednostni sistem političnih gibanj in strank itd.) in številnih drugih
okoliščine (na primer politične razmere v državi).
Predmeti politike (tj. družbeni odnosi, področja javnega življenja, na katera je politika usmerjena) so različni. Notranja politika ureja odnose, ki izhajajo iz izvajanja politične oblasti znotraj družbe, zunanja politika pa ureja odnose med državami v mednarodnem prostoru. Po drugi strani pa se glede na cilje, na katere je usmerjena notranja politika, razlikujejo gospodarska, socialna, kulturna, vojaška, okoljska politika itd.
Vstopnica številka 15
Po čl. 55 Zveznega zakona št. 61-FZ "O prometu zdravil" se trgovina na drobno z zdravili izvaja v skladu s pravili dobre lekarniške prakse (v nadaljnjem besedilu - GAP), ki jih odobri pooblaščeni zvezni izvršni organ.
Oglejmo si podrobneje pravila NAP glede naslednjih točk:
1.
Katera regulativna dokumentacija potrjuje pravila NAP?
1. marca 2017 je začel veljati Odlok Ministrstva za zdravje Ruske federacije z dne 31. avgusta 2017 št. 647n »O odobritvi Pravil dobre lekarniške prakse zdravil za medicinsko uporabo«.
2.
Katere zahteve določajo pravila NAP?
Ta pravilnik določa zahteve za opravljanje trgovine na drobno s strani lekarniških organizacij, samostojnih podjetnikov (IP) z dovoljenjem za lekarniško dejavnost, zdravstvenih organizacij z dovoljenjem za lekarniško dejavnost in njihovih ločenih oddelkov (ambulante, bolnišnične in bolničarsko-porodniške postaje, centri (oddelki) splošne zdravstvene (družinske) prakse), ki se nahajajo v podeželskih naseljih, kjer ni lekarniških organizacij, lekarniških organizacij in zdravstvenih organizacij ali njihovih ločenih oddelkov, če imajo lekarniške organizacije, zdravstvene organizacije, njihovi ločeni oddelki dovoljenje, ki ga določa zakonodaja Ruske federacije o izdaji dovoljenj za posamezne vrste dejavnosti, ki izdajajo narkotične in psihotropne droge posameznikom.
3.
Čemu so namenjene zahteve pravil NAP?
Namen tega pravilnika je zagotoviti prebivalcem kakovostna, učinkovita in varna zdravila, medicinske izdelke ter razkužila, pripomočke in izdelke za osebno higieno, pripomočke za medicinske namene, predmete in sredstva za nego bolnih, novorojenčkov in otroci do treh let, očalna optika in izdelki za nego, mineralne vode, izdelki za medicinsko, otroško in dietno prehrano, prehranska dopolnila, parfumi in kozmetika, medicinske in zdravstveno-vzgojne tiskane publikacije, namenjene promociji zdravega načina življenja.
4.
Kakšna odgovornost je predvidena za kršitev pravil NAP?
V skladu s 5. členom Zveznega zakona št. 61-FZ "O prometu zdravil" so pristojnosti zveznih izvršnih organov (v tem primeru govorimo o Zvezni službi za nadzor v zdravstvu (Roszdravnadzor) in njenih teritorialnih organih) v prometu z zdravili vključuje organizacijo in (ali) izvajanje inšpekcijskih pregledov subjektov v prometu z zdravili glede skladnosti s pravili dobre lekarniške prakse.
Kršitev zahtev pravil NAP je upravni prekršek, odgovornost za katerega je določena v 1. delu čl. 14.4.2 Zakonika o upravnih prekrških Ruske federacije in vključuje naložitev upravne globe: za uradno osebo - od pet tisoč do deset tisoč rubljev, za pravno osebo - od dvajset tisoč do trideset tisoč rubljev.
Na splošno lahko pravila NAP razdelimo na pet glavnih področij, o katerih bomo še razpravljali:
I. Uradne osebe lekarniške organizacije (kakšne so zahteve za vodjo subjekta in kadre v skladu z zahtevami NAP);
II. Obvezna dokumentacija (interni ukazi lekarniške organizacije, licenca itd.);
III. Zahteve za infrastrukturo organizacije;
IV. Ključni operativni procesi (SOP);
V. Notranja revizija (optimizacija dela organizacije in priprava na morebitne preglede regulatornih organov).
JAZ. Zahteve za uradnike lekarniške organizacije.
Za zagotavljanje nemotene oskrbe kupcev s farmacevtskimi izdelki vodja maloprodajnega subjekta organizira:
a) zagotavljanje sistema javnih naročil, ki preprečuje distribucijo ponarejenih, podstandardnih, ponarejenih farmacevtskih izdelkov;
b) opremljanje prostorov z opremo, ki zagotavlja pravilno ravnanje s farmacevtskimi izdelki, vključno z njihovim skladiščenjem, računovodstvom, prodajo in izdajo;
c) dostop do informacij o postopku uporabe ali uporabe farmacevtskih izdelkov, vključno s pravili izdaje, načini uporabe, režimi odmerjanja, terapevtskimi učinki, kontraindikacijami, medsebojnim delovanjem zdravil med sočasnim jemanjem in (ali) s hrano, pravili za njihovo shranjevanje na domu (v nadaljevanju farmacevtsko svetovanje);
d) obveščanje kupcev o razpoložljivosti blaga, vključno z zdravili nižjega cenovnega razreda.
Vodja trgovine na drobno zagotavlja tudi:
a) zmanjšanje proizvodnih izgub, optimizacija dejavnosti, povečanje blagovne menjave, povečanje ravni znanja in usposobljenosti farmacevtskih delavcev;
b) potrebna sredstva za delovanje vseh procesov maloprodajnega subjekta za izpolnjevanje zahtev za izdajo dovoljenj, sanitarnih in epidemioloških zahtev, pravil o zdravju in varnosti pri delu, požarnih predpisov in drugih zahtev, ki jih določa zakonodaja Ruske federacije;
c) razpoložljivost informacijskih sistemov, ki omogočajo delovanje v zvezi z distribucijo blaga in identifikacijo ponarejenih, ponarejenih in podstandardnih zdravil.
Vodja maloprodajnega subjekta zagotavlja in vzdržuje v stanju infrastrukturo, potrebno za izpolnjevanje licenčnih pogojev za opravljanje lekarniške dejavnosti, ki vključuje:
Vodja maloprodajnega subjekta skrbi tudi za obveščanje delavcev o:
a) trenutna pravila NAP in njihovo skladnost;
b) pravice in obveznosti, določene z opisom delovnih mest in strokovnimi standardi;
c) informacije o spremembah zakonodaje Ruske federacije, ki ureja pravna razmerja, ki nastanejo med prometom farmacevtskih izdelkov, vključno s spremembami pravil za izdajo zdravil;
d) podatke o rezultatih notranjih in zunanjih presoj;
e) informacije o potrebnih preventivnih in korektivnih ukrepih za odpravo (preprečevanje) kršitev licenčnih zahtev;
f) informacije o rezultatih obravnave pritožb in predlogov strank.
Vodja maloprodajnega subjekta analizira sistem kakovosti v skladu z urnikom, ki ga potrdi.
Analiza vključuje oceno možnosti izboljšav in potrebe po spremembah organizacije sistema kakovosti, vključno s usmeritvami in cilji delovanja, in se izvaja z upoštevanjem rezultatov notranjih presoj (inšpekcij), knjige recenzije in predlogi, vprašalniki, ustne želje strank (povratne informacije kupca), sodobni dosežki znanosti in tehnike, članki, ocene in drugi podatki
Na podlagi rezultatov analize sistema kakovosti lahko vodja maloprodajnega subjekta odloči o potrebi in (ali) smiselnosti povečanja učinkovitosti sistema kakovosti in njegovih procesov, izboljšanja kakovosti farmacevtskih storitev, sprememb v potrebe po virih (materialnih, finančnih, delovnih in drugih), potrebnih investicijah za izboljšanje storitev za stranke, sistemih motiviranja zaposlenih, dodatnem izobraževanju (inštrukcijah) zaposlenih in drugih rešitvah.
Prav tako vodja maloprodajnega subjekta zagotavlja analizo skladnosti s politikami in poslovnimi cilji, notranja revizijska poročila in zunanje inšpekcije za izboljšanje opravljenih farmacevtskih storitev.
Vprašanja glede:
- osebje,
- prostori,
- oprema,
- dokumentacijo,
- spoštovanje pravil prometa s farmacevtskimi izdelki,
- aktivnosti za delo z ocenami in predlogi strank,
- delo za prepoznavanje ponarejenih, podstandardnih, ponarejenih farmacevtskih izdelkov, kot tudi
- notranjo revizijo mora analizirati vodja maloprodajnega subjekta v skladu s sprejetim terminskim načrtom.
Pravila NAP določajo, da mora imeti subjekt trgovine na drobno glede na obseg farmacevtskih storitev, ki jih opravlja, potrebne kadre za izpolnjevanje postavljenih zahtev.
Zahteve za kvalifikacije in delovne izkušnje vodje maloprodajnega subjekta in njegovih farmacevtskih delavcev so določene s Pravilnikom o izdaji dovoljenj za farmacevtske dejavnosti (trenutno - Uredba Vlade Ruske federacije z dne 22. decembra 2011 N 1081 "O izdaji dovoljenj"). farmacevtske dejavnosti«).
Prav tako se v pravilniku NAP pojavlja nova klavzula (57. člen), po kateri lahko promet na drobno s farmacevtskim blagom, ki ni povezano z zdravili, opravljajo delavci, ki nimajo farmacevtske izobrazbe ali dodatne strokovne izobrazbe v trgovini na drobno. zdravil, če delajo v ločenih oddelkih (ambulante, bolnišnični in zdravstveno-porodni centri, centri (oddelki) splošne zdravstvene (družinske) prakse) zdravstvenih organizacij, ki imajo dovoljenje za opravljanje farmacevtske dejavnosti in se nahajajo na podeželju, kjer ni lekarne. organizacije.
Opozoriti je treba, da v tem primeru govorimo posebej o lekarniških izdelkih, ki niso povezani z zdravili. Prodaja zdravil s strani zaposlenih, ki nimajo farmacevtske izobrazbe ali dodatne strokovne izobrazbe v prometu z zdravili na drobno, se bo štela za prekršek in bo povzročila upravno odgovornost!
Kar zadeva neposredne zahteve za osebje lekarniške organizacije, mora biti vsak zaposleni seznanjen s svojimi pravicami in odgovornostmi, ki jih vsebujejo opisi delovnih mest in poklicni standardi.
Prav tako mora imeti zaposleni, ki opravlja delo, ki vpliva na kakovost izdelkov, potrebne kvalifikacije in delovne izkušnje za izpolnjevanje zahtev, ki jih določa pravilnik NAP.
Pravila NAP določajo tudi glavne naloge farmacevtskih delavcev:
a) prodaja farmacevtskega blaga ustrezne kakovosti;
b) zagotavljanje zanesljivih informacij o farmacevtskih izdelkih, njihovih stroških, farmacevtsko svetovanje;
c) informacije o smotrni uporabi zdravil za namen odgovornega samozdravljenja;
d) proizvodnja zdravil po receptih in zahtevah računov zdravniških organizacij;
e) priprava knjigovodske dokumentacije;
f) spoštovanje poklicne etike.
II. Obvezna dokumentacija.
Vso obvezno dokumentacijo lekarniške organizacije lahko razdelimo na 9 glavnih blokov:
- dokumentacijo o osebju lekarne;
- dovoljenje za opravljanje lekarniške dejavnosti;
- dokumenti, ki potrjujejo kakovost farmacevtskih izdelkov;
- poročila o pregledih;
- registri;
- dnevnike, ki jih je treba voditi v skladu s pravili NAP;
- dokumentacija o opremi;
- SOP (dokumenti o standardnih operativnih postopkih);
- interna naročila.
Dokumentacija o osebju lekarne.
Dokumentacijo sistema kakovosti vzdržujejo zaposleni, ki jih pooblasti vodja maloprodajnega subjekta, na papirju in (ali) elektronskih medijih in med drugim vključuje osebne izkaznice zaposlenih v maloprodajnem subjektu;
a) organizacijska struktura;
b) notranji delovni red;
c) opise delovnih mest z opombo o seznanitvi delavcev na ustreznih položajih;
d) osebje.
Za novo zaposlene delavce se v skladu z lokalnimi predpisi maloprodajnega subjekta izvaja prilagoditveni program in se redno preverja usposobljenost, znanje in izkušnje zaposlenih.
Prilagoditveni program med drugim vključuje:
a) uvajalno usposabljanje ob zaposlitvi;
b) usposabljanje (inštrukcije) na delovnem mestu (začetno in ponavljajoče);
c) obnavljanje znanja:
- zakonodaja Ruske federacije na področju prometa zdravil in varstva javnega zdravja, varstva pravic potrošnikov;
- pravila osebne higiene;
- o postopku opravljanja farmacevtskih storitev, vključno s farmacevtskim svetovanjem in uporabo zdravil na domu;
- razvoj komunikacijskih veščin in preprečevanje konfliktov;
- navodila o varnosti in varstvu pri delu.
Vodja maloprodajnega subjekta zagotavlja, da se začetno in nadaljnje usposabljanje (inštrukcija) zaposlenih izvaja v skladu z urnikom, ki ga odobri:
a) pravila za izdajo zdravil za medicinsko uporabo;
b) pravila za izdajo mamil in psihotropnih snovi (NS in PS), registriranih kot zdravila, zdravil, ki vsebujejo NS in PS;
c) pravila za izdajo zdravil, za katera velja predmetno-količinsko knjigovodstvo (SQR), pravila za vodenje dnevnika zdravil, za katere velja SQR;
d) pravila izdajanja zdravil, ki vsebujejo majhne količine prepovedanih drog (NS);
e) postopek shranjevanja receptov;
f) izpolnjevanje zahtev glede razpoložljivosti minimalnega asortimana;
g) skladnost z zahtevami dobre prakse za shranjevanje in transport zdravil;
h) uporaba določenih najvišjih zneskov maloprodajnih pribitkov na dejanske prodajne cene proizvajalcev za zdravila, uvrščena na seznam nujnih in osnovnih zdravil, postopek oblikovanja cen teh zdravil;
i) izpolnjevanje zahtev za delo s ponarejenimi, nekakovostnimi, ponarejenimi farmacevtskimi izdelki;
j) upoštevanje omejitev, ki veljajo za farmacevtske delavce pri opravljanju njihove poklicne dejavnosti;
k) izboljšanje znanja o zdravilih, vključno z generičnimi in medsebojno zamenljivimi zdravili, sposobnost zagotavljanja primerjalnih informacij o zdravilih in cenah, tudi o zdravilih nižjega cenovnega razreda, o novih zdravilih, oblikah, indikacijah za uporabo;
l) metode obdelave podatkov, prejetih od kupcev o vprašanjih, povezanih z uporabo zdravil, ugotovljenih med uporabo, stranskih učinkih, posredovanje teh informacij zainteresiranim stranem;
m) skladnost z zahtevami varstva pri delu.
Tako mora urnik začetnega in nadaljnjega usposabljanja zaposlenih nujno vključevati vse zgoraj navedene točke.
Dovoljenje za opravljanje lekarniške dejavnosti.
Dokumentacijo sistema kakovosti vzdržujejo delavci, ki jih pooblasti vodja maloprodajnega subjekta, na papirju in (ali) elektronskem mediju in med drugim vključuje dovoljenje za opravljanje lekarniške dejavnosti in priloge k njej.
Dokumenti, ki potrjujejo kakovost farmacevtskih izdelkov.
Dokumentacijo sistema kakovosti vzdržujejo zaposleni, ki jih pooblasti vodja maloprodajnega subjekta, na papirju in (ali) elektronskih medijih in med drugim zajema dokumente, ki se nanašajo na prekinitev (ponovno) prodajo farmacevtskih izdelkov, odpoklic (umik) zdravila iz prometa, ugotavljanje primerov prometa neregistriranih zdravil.
Upoštevajte, da mora vzdrževanje te dokumentacije organizirati posebej pooblaščeni uslužbenec; Prav tako je treba spremljati informacije, prejete od organov Roszdravnadzorja o prekinitvi (ponovni vzpostavitvi) prodaje farmacevtskih izdelkov, odpoklicu (umiku) zdravil iz prometa in ugotavljanju primerov prometa neregistriranih medicinskih pripomočkov.
Inšpekcijska poročila.
Dokumentacijo sistema kakovosti vzdržujejo delavci, ki jih pooblasti vodja maloprodajnega subjekta, na papirju in (ali) elektronskih medijih in med drugim vključuje poročila o inšpekcijskih pregledih maloprodajnega subjekta s strani uradnikov državnih kontrolnih (nadzornih) organov, občinskega nadzora. organi in notranje revizije.
Registri.
Dokumenti o učinkovitem načrtovanju dejavnosti, izvajanju procesov za zagotavljanje sistema kakovosti in njihovem upravljanju glede na funkcije, ki jih opravlja subjekt trgovine na drobno, vključujejo register registriranih cen zdravil, uvrščenih na listo nujnih in esencialnih zdravil.
Te informacije (najvišje maloprodajne cene vitalnih in osnovnih zdravil) je treba v skladu z zveznim zakonom št. 61-FZ "O prometu zdravil" sporočiti obiskovalcem lekarniške organizacije.
Dnevniki, ki jih je treba vzdrževati v skladu s pravili NAP.
Dokumenti o učinkovitem načrtovanju dejavnosti, izvajanju procesov za zagotavljanje sistema kakovosti in njihovem vodenju glede na funkcije, ki jih opravlja maloprodajni subjekt, vključujejo:
e) dnevnik uvodnega sestanka o varstvu pri delu;
f) dnevnik registracije navodil na delovnem mestu;
g) dnevnik sestankov s požarno varnostjo;
h) dnevnik sestankov o električni varnosti;
i) dnevnik naročil (navodil) za trgovino na drobno;
j) dnevnik dnevne registracije parametrov temperature in vlažnosti v prostorih za shranjevanje zdravil, medicinskih pripomočkov (MD) in prehranskih dopolnil;
k) dnevnik periodičnega beleženja temperature v hladilni opremi;
l) dnevnik transakcij, povezanih s prometom zdravil, vključenih v seznam zdravil, ki so predmet PCU (če so ta zdravila na voljo) - oblika dnevnika je odobrena z Odlokom Ministrstva za zdravje Ruske federacije z dne 17. junija. , 2013 N 378n „O odobritvi pravil za registracijo transakcij v zvezi z prometnimi zdravili za medicinsko uporabo, vključenimi v seznam zdravil za medicinsko uporabo, ki so predmet predmetno-količinskega računovodstva, v posebnih dnevnikih transakcij v zvezi s prometom zdravil za medicinsko uporabo ter pravila za vodenje in hrambo posebnih dnevnikov prometa v zvezi s prometom zdravil za medicinsko uporabo«;
m) dnevnik inšpekcijskih pregledov pravne osebe, samostojnega podjetnika, ki jih izvajajo državni nadzorni (nadzorni) organi, občinski nadzorni organi (če obstajajo) - obrazec dnevnika je odobren z zveznim zakonom z dne 26. decembra 2008 N 294. -FZ "O varstvu pravic pravnih oseb in samostojnih podjetnikov pri izvajanju državnega nadzora (nadzora) in občinskega nadzora";
o) dnevnik za izdajo zdravil, ki so vključena v minimalni nabor zdravil, potrebnih za zagotavljanje zdravstvene oskrbe, vendar niso na voljo v času zahteve kupca;
o) dnevnik nepravilno napisanih receptov;
p) dnevnik za zdravila z omejenim rokom uporabnosti;
c) dnevnik napak;
r) laboratorijski dnevnik pakiranja;
s) dnevnik transakcij, povezanih s prometom prepovedanih drog, psihotropnih snovi in njihovih predhodnih sestavin (če so ta zdravila na voljo) - obrazec dnevnikov je odobren z Odlokom Vlade Ruske federacije z dne 9. junija 2010 N 419. "O zagotavljanju informacij o dejavnostih, povezanih s prometom predhodnih sestavin drog in psihotropnih snovi ter registraciji transakcij, povezanih z njihovim prometom" in Odlokom Vlade Ruske federacije z dne 4. novembra 2006 N 644 "O postopku za posredovanje podatkov o dejavnostih v zvezi s prometom s prepovedanimi drogami in psihotropnimi snovmi ter evidentiranje poslov v zvezi s prometom s prepovedanimi drogami in psihotropnimi snovmi«;
t) dnevnik za evidentiranje rezultatov prevzemne kontrole;
x) dnevnik prejema in porabe cepiv (če so ta zdravila na voljo);
v) dnevnik receptov, ki so bili (so) na odloženem izvajanju (če so na voljo subvencionirana zdravila);
h) revija informacijskega dela z zdravstvenimi organizacijami o postopku za brezplačno oskrbo določenih kategorij državljanov z zdravili in medicinskimi pripomočki (MD) ter prodajo zdravil in MI s popustom.
Dokumentacija o opremi.
Oprema, ki jo uporablja maloprodajni subjekt in je povezana z merilnimi instrumenti, je predmet začetnega preverjanja in (ali) kalibracije pred zagonom, pa tudi po popravilu in (ali) vzdrževanju, med delovanjem pa je predmet rednega preverjanja in (ali) kalibracije v v skladu z zahtevami zakonodaje Ruske federacije za zagotovitev enotnosti meritev.
V skladu s tem morajo biti na voljo dokumenti, ki potrjujejo verifikacijo navedene opreme (v primeru revizije lekarniške organizacije s strani regulativnega organa).
SOP (dokumenti standardnega operativnega postopka).
Dokumentacija sistema kakovosti med drugim zajema dokumente, ki opisujejo postopek izvajanja farmacevtskih storitev maloprodajnega subjekta (v nadaljevanju standardni operativni postopki – SOP).
Treba je opozoriti, da standardni operativni postopki vključujejo določen postopek za zaposlene in njihove odgovornosti za določen postopek (odgovorni za jemanje zdravil, njegov postopek, odgovorni za pripravo pred prodajo, njegova dejanja itd.)
Vodja maloprodajnega subjekta zagotavlja odobritev standardnih operativnih postopkov (to je interni ukaz, ki bo obravnavan v nadaljevanju).
Vsi procesi maloprodajnega subjekta, ki vplivajo na kakovost, učinkovitost in varnost farmacevtskih izdelkov, potekajo v skladu z odobrenimi standardnimi operativnimi postopki ( pribl. v poglavju »Procesi dejavnosti maloprodajnega subjekta farmacevtskih izdelkov« se nanaša na procese nabave, prevzema in predprodajne priprave).
Če povzamemo, SOP v lekarniški organizaciji je treba razviti za naslednje procese:
- nakup farmacevtskega blaga;
- njihov sprejem;
- skladiščenje;
- priprava pred prodajo;
- prodaja farmacevtskih izdelkov;
- nadzor kakovosti.
V primeru neskladja med dobavljenim farmacevtskim blagom trgovskemu subjektu in pogoji pogodbe ter spremnimi listinami komisija maloprodajnega subjekta po potrjenem standardnem operativnem postopku sestavi akt, s katerim je podlaga za vložitev zahtevkov do dobavitelja (sestava akta s strani finančno odgovorne osebe je možna s soglasjem dobavitelja ali v odsotnosti njegovega predstavnika).
Zato je treba SOP razviti tudi za postopke za pripravo poročila o zahtevkih za dobavitelja ter identifikacijo in izolacijo ponarejenih, podstandardnih, ponarejenih farmacevtskih izdelkov.
Standardni operativni postopki morajo opisovati, kako:
a) analiziranje pritožb in predlogov strank ter sprejemanje odločitev o njih;
b) ugotavljanje razlogov za kršitev zahtev pravil NAP in drugih zahtev regulativnih pravnih aktov, ki urejajo promet farmacevtskega blaga;
c) ocenjevanje potrebe in izvedljivosti sprejetja ustreznih ukrepov za preprečitev ponovne podobne kršitve;
d) prepoznavanje in izvajanje potrebnih ukrepov za preprečitev, da bi ponarejeni, podstandardni in ponarejeni farmacevtski izdelki prišli do kupca;
e) analiziranje učinkovitosti sprejetih preventivnih in korektivnih ukrepov.
Tako pravila NAP ne odobrijo jasno določene oblike standardnih operativnih postopkov (podroben ali kratek opis dejanj, s sklicevanjem na regulativno dokumentacijo ali brez nje).
Vsaka lekarniška organizacija ima možnost zapisati svoje standardne operativne postopke, vendar morajo biti zgoraj navedeni postopki vključeni v SOP lekarniške organizacije. Če obstaja potreba po novih SOP za povečanje učinkovitosti in optimizacijo dejavnosti, ima lekarniška organizacija vso pravico, da s svojim internim ukazom uvede nov SOP.
Interna naročila.
Dokumentacijo sistema kakovosti vodijo zaposleni, ki jih pooblasti vodja maloprodajnega subjekta, na papirju in (ali) elektronskih medijih in med drugim vključuje odredbe in navodila vodje maloprodajnega subjekta o glavni dejavnosti.
Nato bodo navedena približna imena teh notranjih ukazov (lahko jih spremeni organizacija sama, vendar ne da bi izgubili glavni pomen) in odstavek pravil NAP, ki določa zahteve za te ukaze.
- »O izvajanju sklopa ukrepov za izpolnjevanje zahtev tega pravilnika dobre lekarniške prakse za zdravila za medicinsko uporabo«
a) določanje procesov, ki vplivajo na kakovost storitev, ki jih opravlja maloprodajni subjekt in so namenjeni zadovoljevanju povpraševanja kupcev po farmacevtskih izdelkih, pridobivanje informacij:
- o pravilih shranjevanja in uporabe zdravil,
- o dostopnosti in ceni zdravil, vključno s prednostnim prejemanjem informacij o razpoložljivosti zdravil nižjega cenovnega razreda;
b) vzpostavitev zaporedja in medsebojnega delovanja procesov, potrebnih za zagotavljanje sistema kakovosti, glede na njihov vpliv na varnost, učinkovitost in racionalnost uporabe zdravil.
c) določitev meril in metod, ki odražajo doseganje rezultatov, tako pri izvajanju procesov, potrebnih za zagotavljanje sistema kakovosti, kot pri njihovem upravljanju, ob upoštevanju zahtev zakonodaje Ruske federacije o prometu z zdravili. ;
d) določitev kvantitativnih in kvalitativnih parametrov, vključno z materialnimi, finančnimi, informacijskimi, delovnimi, potrebnimi za vzdrževanje procesov sistema kakovosti in njihovo spremljanje;
e) zagotavljanje prebivalstvu kakovostnih, varnih in učinkovitih farmacevtskih izdelkov;
f) sprejemanje ukrepov, potrebnih za doseganje načrtovanih rezultatov in nenehno izboljševanje kakovosti storitev za stranke ter večanje osebne odgovornosti zaposlenih.
- »O osebi, odgovorni za izvajanje in zagotavljanje sistema kakovosti«
- »O pooblaščencih za vzdrževanje in hrambo dokumentacije sistema kakovosti«
člen 6. Vodja maloprodajnega subjekta imenuje osebe, odgovorne za vzdrževanje in hrambo zgoraj navedenih dokumentov, omogočanje dostopa do njih in po potrebi njihovo obnovitev.
- "O politiki in ciljih dejavnosti"
a) dokument o usmeritvi in ciljih subjekta trgovine na drobno, ki opredeljuje načine za zagotavljanje povpraševanja kupcev po farmacevtskih izdelkih, zmanjšanje tveganja, da pridejo v javni promet nekakovostna, ponarejena in ponarejena zdravila, medicinski pripomočki in prehranska dopolnila;
člen 7. Vodja subjekta trgovine na drobno zagotavlja:
b) opredelitev politik in ciljev delovanja za ... učinkovito interakcijo med zdravstvenim delavcem, farmacevtskim delavcem in kupcem;
- "O potrditvi priročnika kakovosti"
b) priročnik o kakovosti, ki določa smeri razvoja maloprodajnega subjekta, tudi za določeno časovno obdobje, in vsebuje sklicevanja na zakonodajne in druge regulativne pravne akte, ki urejajo izvajanje farmacevtske dejavnosti;
- "O odobritvi standardnih operativnih postopkov"
c) dokumente, ki opisujejo postopek izvajanja farmacevtskih storitev trgovskega subjekta na drobno (v nadaljnjem besedilu: standardni poslovni postopki);
g) odobritev standardnih operativnih postopkov;
odstavek 37. Vsi procesi maloprodajnega subjekta, ki vplivajo na kakovost, učinkovitost in varnost farmacevtskih izdelkov, potekajo v skladu z odobrenimi standardnimi operativnimi postopki.
- "O odobritvi ukrepov za spodbujanje in motiviranje dejavnosti zaposlenih"
f) razvoj aktivnosti za spodbujanje in motiviranje aktivnosti zaposlenih;
- "O vzpostavitvi notranjega postopka za izmenjavo informacij"
h) vzpostavitev internega postopka za izmenjavo informacij, vključno z informacijami v zvezi z delovanjem sistema kakovosti, tudi z uporabo pisne oblike (seznanilni list), oglasnimi stojnicami na javnih mestih, informativnimi sestanki z določeno frekvenco, elektronska distribucija informacij na elektronski naslov;
- "O potrditvi načrta analize sistema kakovosti"
Analiza vključuje oceno možnosti izboljšav in potrebe po spremembah organizacije sistema kakovosti, vključno s usmeritvami in cilji delovanja, in se izvaja z upoštevanjem rezultatov notranjih presoj (inšpekcij), knjige recenzije in predlogi, vprašalniki, ustne želje kupcev (povratne informacije kupca), sodobni dosežki znanosti in tehnike, članki, ocene in drugi podatki.
- "O odobritvi obrazcev revij"
- "O potrditvi razporeda zaposlenih"
- seznam strukturnih enot,
- nazivi delovnih mest,
- specialitete,
- poklici, ki označujejo kvalifikacije,
- podatke o številu kadrovskih enot
- in plačni sklad.
Treba je opozoriti, da mora biti ta notranji red na seznamu in imenih delovnih mest v skladu z odredbo Ministrstva za zdravje Ruske federacije z dne 20. decembra 2012 N 1183n „O odobritvi nomenklature delovnih mest zdravstvenih delavcev in farmacevtskih delavcev. ”
- "O potrditvi prilagoditvenega programa za novo zaposlene delavce"
Prilagoditveni program med drugim vključuje:
a) uvajalno usposabljanje ob zaposlitvi;
b) usposabljanje (inštrukcije) na delovnem mestu (začetno in ponavljajoče);
c) obnavljanje znanja:
- zakonodaja Ruske federacije na področju prometa zdravil in varstva javnega zdravja, varstva pravic potrošnikov;
- pravila osebne higiene;
- o postopku opravljanja farmacevtskih storitev, vključno s farmacevtskim svetovanjem in uporabo zdravil na domu;
d) razvoj komunikacijskih veščin in preprečevanje konfliktov;
e) navodila o varnosti in varstvu pri delu.
- "O odobritvi urnika začetnega in nadaljnjega usposabljanja (pouka) zaposlenih"
a) pravila za izdajo zdravil za medicinsko uporabo;
b) pravila za izdajo NS in PV, registriranih kot zdravila (MD), zdravil, ki vsebujejo NS in PV;
c) pravilnik o sproščanju zdravil, ki so predmet PKU, pravilnik o vodenju dnevnika zdravil, ki so predmet PKU;
d) pravila za izdajo zdravil, ki vsebujejo majhne količine NS;
e) postopek shranjevanja receptov;
f) izpolnjevanje zahtev glede razpoložljivosti minimalnega asortimana;
g) izpolnjevanje zahtev dobre prakse za shranjevanje in transport zdravil;
h) uporaba določenih najvišjih zneskov maloprodajnih pribitkov na dejanske prodajne cene proizvajalcev za zdravila, uvrščena na seznam nujnih in osnovnih zdravil, postopek oblikovanja cen teh zdravil;
i) izpolnjevanje zahtev za delo s ponarejenimi, nekakovostnimi, ponarejenimi farmacevtskimi izdelki;
j) upoštevanje omejitev, ki veljajo za farmacevtske delavce pri opravljanju njihove poklicne dejavnosti;
k) izboljševanje znanja o zdravilih, vključno z generičnimi zdravili, medsebojno zamenljivimi zdravili, sposobnost podajanja primerjalnih informacij o zdravilih in cenah, tudi o zdravilih nižjega cenovnega razreda, o novih zdravilih, oblikah zdravil, indikacijah za uporabo zdravil;
l) metode za obdelavo podatkov, prejetih od kupcev o vprašanjih uporabe drog, ugotovljenih v postopku prijave, neželenih učinkih, posredovanje teh informacij zainteresiranim stranem;
m) skladnost z zahtevami varstva pri delu.
- "O odobritvi con in prostorov, ki jih uporabljajo subjekti trgovine na drobno"
- "O dostopu do prostorov (območij), ki jih uporabljajo subjekti trgovine na drobno"
- "O odobritvi postopka izbire in ocenjevanja dobaviteljev farmacevtskih izdelkov"
- "O materialno odgovornih osebah, ki sprejemajo farmacevtsko blago"
- "O ustanovitvi komisije za odškodninske zahtevke"
- "O ustanovitvi izbirne komisije"
„O odobritvi urnika za analizo vprašanj v zvezi z osebjem, prostori, opremo, dokumentacijo, skladnostjo s pravili trgovine s farmacevtskimi izdelki, ukrepi za delo s pregledi in predlogi strank, delom za prepoznavanje ponarejenih, podstandardnih, ponarejenih farmacevtskih izdelkov. , ter aktivnosti na področju izvajanja notranje revizije"
člen 60. Kadrovska, prostorska, oprema, dokumentacija, spoštovanje pravil trgovanja s farmacevtskimi izdelki, ukrepi za delo z ocenami in predlogi strank, delo za odkrivanje ponarejenih, podstandardnih, ponarejenih farmacevtskih izdelkov ter aktivnosti za izvajanje notranjih presoj, mora analizirati vodja maloprodajnega subjekta v skladu s potrjenim urnikom.
- "O označevanju farmacevtskih izdelkov, ki ne izpolnjujejo zahtev regulativne dokumentacije, kraja in načina identifikacije karantenskega območja" in
- "O osebi, odgovorni za delo s farmacevtskimi izdelki, ki ne izpolnjujejo zahtev regulativne dokumentacije"
III. Zahteve za infrastrukturo organizacije.
Osnovne zahteve za infrastrukturo lekarniške organizacije lahko razdelimo na 4 glavne sklope:
- Splošni pogoji;
- postavitev;
- končna obdelava;
-opremo.
Splošni pogoji.
Infrastruktura, potrebna za izpolnjevanje zahtev za izdajo dovoljenj za farmacevtske dejavnosti, vključuje, vendar ni omejena na:
a) zgradbe, delovni prostor in pripadajoča delovna oprema;
b) oprema za procese (strojna in programska oprema);
c) podporne storitve (transportni, komunikacijski in informacijski sistemi).
Prostori in oprema morajo biti locirani, opremljeni in upravljani tako, da ustrezajo funkcijam, ki jih opravljajo (v prostoru za shranjevanje zdravil se ne smejo hraniti osebna zdravila zaposlenih ali hrana ipd.)
Postavitev.
Postavitev in zasnova prostorov in opreme morata čim bolj zmanjšati tveganje napak in omogočiti učinkovito čiščenje in vzdrževanje, da se prepreči nabiranje prahu ali umazanije in kakršnih koli dejavnikov, ki bi lahko negativno vplivali na kakovost lekarniških izdelkov.
Vsi prostori maloprodajnega subjekta morajo biti v stavbi (zgradbi) in
funkcionalno združeni, izolirani od drugih organizacij in zagotavljajo odsotnost nepooblaščenega dostopa nepooblaščenih oseb v prostore.
Vstop (izstop) na ozemlje maloprodajnega subjekta je dovoljen skozi prostore druge organizacije.
Območje prostorov, ki jih uporablja maloprodajni subjekt, mora biti razdeljeno na cone, namenjene opravljanju naslednjih funkcij:
a) trgovina s farmacevtskimi izdelki z zagotavljanjem skladiščnih mest, ki ne omogočajo prostega dostopa kupcev do prodanega blaga, vključno s tistimi na recept;
b) sprejem farmacevtskega blaga, prostor za karantensko skladiščenje, vključno ločeno za zdravila;
c) ločeno skladiščenje delavskih oblačil.
Če se maloprodajni subjekt nahaja v stavbi skupaj z drugimi organizacijami, je dovoljena skupna uporaba kopalnice.
Prostori trgovskega subjekta morajo biti načrtovani in opremljeni tako, da so zaščiteni pred vdorom žuželk, glodalcev ali drugih živali.
Končna obdelava.
Prostori morajo biti v skladu s sanitarnimi in higienskimi standardi in zahtevami ter zagotavljati zmožnost opravljanja osnovnih funkcij maloprodajnega subjekta v skladu z zahtevami, odobrenimi s pravili NAP.
Prostori maloprodajnega subjekta morajo biti opremljeni s sistemi ogrevanja in klimatizacije (če so na voljo), naravnim ali prisilnim prezračevanjem (če so na voljo), ki zagotavljajo delovne pogoje v skladu z delovno zakonodajo Ruske federacije, pa tudi skladnost z zahtevami dobre prakse za shranjevanje in transport zdravil.
Prostori trgovskega subjekta imajo lahko naravno in umetno razsvetljavo.
V vseh prostorih je treba zagotoviti splošno umetno razsvetljavo, za posamezna delovna mesta, če je potrebno, lokalno umetno razsvetljavo.
Materiali, uporabljeni pri dodelavi in (ali) popravilu prostorov (območij), morajo izpolnjevati zahteve požarne varnosti, ki jih določa zakonodaja Ruske federacije.
V prostorih maloprodajnega subjekta, namenjenega izdelavi zdravil, morajo biti površine sten in stropov gladke, brez poseganja v celovitost prevleke (vodoodporne barve, emajli ali svetle glazirane ploščice), obdelane z materiali, ki omogočajo mokro čiščenje z uporabo razkužil (neglazirane keramične ploščice, linolej z obveznim varjenjem šivov ali drugih materialov).
Stičišče sten s stropom in tlemi ne sme imeti vdolbin, izboklin ali vogalov.
Subjekt trgovine na drobno mora zagotoviti možnost neoviranega vstopa in izstopa invalidov v skladu z zahtevami zakonodaje o varstvu invalidov.
Če konstrukcijska značilnost stavbe ne omogoča ureditve vhoda in izhoda za invalide, mora trgovski subjekt organizirati možnost klicanja farmacevta za oskrbo teh oseb.
Trgovski subjekt mora imeti znak, ki označuje:
a) vrsta lekarniške organizacije v ruskem in državnih jezikih: "Lekarna" ali "Lekarniška točka" ali "Lekarniški kiosk";
b) polno in (če obstaja) skrajšano firmo, vključno s firmo ter organizacijsko in pravno obliko subjekta trgovine na drobno;
c) način delovanja.
Subjekt trgovine na drobno, ki prodaja zdravila ponoči, mora imeti svetlobno tablo z obvestilom o delu ponoči.
Kadar se trgovski subjekt nahaja v stavbi, mora biti znak nameščen na zunanji steni stavbe, če to ni mogoče, je dovoljeno namestiti znak, katerega zahteve so podobne zahtevam za znak. .
Oprema.
Subjekt trgovine na drobno mora imeti opremo in inventar, ki zagotavljata ohranjanje kakovosti, učinkovitosti in varnosti farmacevtskih izdelkov.
Prostori za shranjevanje zdravil morajo biti opremljeni z opremo, ki omogoča njihovo shranjevanje ob upoštevanju zahtev dobre prakse za shranjevanje in transport zdravil.
Oprema, ki jo uporablja maloprodajni subjekt, mora imeti tehnične potne liste, ki se hranijo ves čas delovanja opreme.
Prostori, pa tudi oprema, ki jo uporablja maloprodajni subjekt pri opravljanju dejavnosti, morajo izpolnjevati sanitarne zahteve, požarno varnost in varnostne predpise v skladu z zakonodajo Ruske federacije.
Oprema mora biti nameščena na razdalji najmanj 0,5 metra od sten ali druge opreme, da se omogoči dostop za čiščenje, razkuževanje, popravilo, vzdrževanje, preverjanje in (ali) kalibracijo opreme, da se zagotovi dostop do farmacevtskih izdelkov in prost prehod. za delavce ( v tem primeru, če ni mogoče vzdrževati določene razdalje 0,5 metra, je treba glavno pozornost nameniti bistvu te točke: mora biti dostop za čiščenje, razkuževanje, popravila, prost prehod delavcev, itd.).
Oprema ne sme ovirati naravnih ali umetnih virov svetlobe in
blokirati prehode.
Maloprodajni prostori in (ali) območja morajo biti opremljeni z vitrinami, regali (gondolami) - z odprtim prikazom blaga, ki zagotavljajo možnost pregleda farmacevtskih izdelkov, dovoljenih za prodajo, in zagotavljajo udobje pri delu za zaposlene v maloprodaji. trgovski subjekt.
IV. Ključni operativni procesi (SOP).
Glavni procesi lekarniške organizacije so razdeljeni na 7 sklopov:
- Splošni pogoji;
- nabava;
- Sprejem;
- priprava pred prodajo;
- Skladiščenje;
- Izvedba;
- Kontrola kakovosti.
Splošni pogoji.
Vsi procesi maloprodajnega subjekta, ki vplivajo na kakovost, učinkovitost in varnost farmacevtskih izdelkov, potekajo v skladu z odobrenimi standardnimi operativnimi postopki.
Nakup.
Vodja maloprodajnega subjekta mora potrditi postopek izbire in ocenjevanja dobaviteljev farmacevtskih izdelkov, pri čemer mora med drugim upoštevati naslednja merila:
a) skladnost dobavitelja z zahtevami veljavne zakonodaje Ruske federacije o licenciranju določenih vrst dejavnosti;
b) poslovni ugled dobavitelja na farmacevtskem trgu, ki temelji na prisotnosti dejstev odpoklica ponarejenih, podstandardnih, ponarejenih farmacevtskih izdelkov, neizpolnjevanja sprejetih pogodbenih obveznosti, odredb pooblaščenih državnih nadzornih organov o dejstvih kršitve zahtev zakonodaja Ruske federacije;
c) povpraševanje po farmacevtskih izdelkih, ki jih dobavitelj ponuja za nadaljnjo prodajo, skladnost kakovosti farmacevtskih izdelkov z zahtevami zakonodaje Ruske federacije;
d) skladnost dobavitelja z zahtevami, ki jih določajo pravila NAP za pripravo dokumentacije, razpoložljivost dokumenta s seznamom izjav o skladnosti proizvoda z uveljavljenimi zahtevami, protokol za dogovor o cenah za zdravila, vključena v seznam vitalna in esencialna zdravila;
e) skladnost dobavitelja s temperaturnimi pogoji med prevozom termolabilnih zdravil, vključno z imunobiološkimi zdravili;
f) zagotavljanje garancije kakovosti s strani dobavitelja za dobavljene farmacevtske izdelke;
g) konkurenčnost pogodbenih pogojev, ki jih ponuja dobavitelj;
h) ekonomsko izvedljivost pogojev dobave blaga, ki jih predlaga dobavitelj (število dobavljenih paketov, minimalni znesek dostave);
i) zmožnost dobave široke ponudbe;
j) skladnost dobavnega roka z delovnim časom maloprodajnega subjekta.
Maloprodajni subjekt in dobavitelj skleneta pogodbo ob upoštevanju zahtev zakonodaje o osnovah državne ureditve trgovinske dejavnosti v Ruski federaciji, pa tudi ob upoštevanju zahtev civilne zakonodaje, ki določa roke za dobavitelj sprejema reklamacije glede kakovosti izdelkov, kot tudi možnost vračila ponarejenih, nekakovostnih, ponarejenih farmacevtskih izdelkov dobavitelju, če je bila informacija o tem prejeta po prevzemu blaga in izvedbi ustreznih dokumentov.
V zvezi s farmacevtskimi izdelki (razen medicinskih izdelkov) lahko trgovec na drobno dobavitelju opravlja storitve na podlagi povračila stroškov, katerih predmet je izvajanje dejavnosti, ki so ekonomsko koristne za dobavitelja in prispevajo k povečanju prodaje lekarniške dejavnosti. izdelkov (razen medicinskih izdelkov) in zvestobe strank.
Dobavitelj se samostojno odloči, ali mora tovrstne storitve kupiti, vsiljevanje storitev dobavitelju s strani maloprodajnega subjekta pa ni dovoljeno.
Nakup farmacevtskega blaga s strani maloprodajnega subjekta, ustanovljenega v obliki državnega in občinskega enotnega podjetja, se izvaja v skladu z zahtevami zakonodaje Ruske federacije o pogodbenem sistemu na področju nabave blaga, del, storitve za zadovoljevanje državnih in občinskih potreb.
Sprejemanje.
Prevzem farmacevtskih izdelkov izvaja finančno odgovorna oseba (za imenovanje mora obstajati interni ukaz).
V postopku prevzema farmacevtskega blaga, vključno s tistim, ki zahteva posebne pogoje skladiščenja in varnostne ukrepe, skladnost prevzetega blaga z odpremno dokumentacijo glede sortimenta, količine in kakovosti, skladnost s posebnimi pogoji skladiščenja (če obstaja taka zahteva) , ter se preveri poškodovanost transportne embalaže.
Pristojnost subjekta trgovine na drobno za preverjanje kakovosti dobavljenega farmacevtskega blaga je omejena na vizualni pregled videza, preverjanje skladnosti s spremnimi dokumenti, popolnost kompleta spremnih dokumentov, vključno z registrom listin, ki potrjujejo kakovost farmacevtskega blaga. .
Maloprodajni subjekt mora upoštevati posebnosti prevzema in predprodajnega pregleda farmacevtskih izdelkov (na primer, če izdelek zahteva skladiščenje pri temperaturi 2-8 °C, je treba takoj zagotoviti izpolnjevanje te zahteve in premaknite navedeni izdelek v hladilnik). V tem primeru je treba opozoriti, da se izraz "lekarniški izdelki" nanaša tako na zdravila kot na nezdravila.
Če so farmacevtski izdelki v transportni embalaži nepoškodovani, se lahko prevzem izvede po številu mest ali po številu enot izdelka in oznakah na embalaži.
Če količina in kakovost farmacevtskih izdelkov ustrezata tistim, navedenim v spremnih dokumentih, se na spremne dokumente (tovorni list, račun, tovorni list, register dokumentov o kakovosti in druge listine, ki potrjujejo količino ali kakovost blaga) odtisne prevzemni žig. prejeto), ki potrjuje skladnost sprejetih farmacevtskih izdelkov s podatki, navedenimi v spremnih dokumentih.
Pogosto vprašanje: ali je v lekarni potreben prevzemni žig? Pravila NAP zahtevajo prisotnost takega žiga.
Finančno odgovorna oseba, ki prevzema farmacevtsko blago, se podpiše na spremne listine in jih overi s pečatom subjekta trgovine na drobno (če obstaja).
Če se dejanska razpoložljivost farmacevtskega blaga v posodah ne preverja, je treba o tem narediti opombo v spremni dokument.
V primeru neskladnosti blaga farmacevtskega asortimana, dobavljenega trgovskemu subjektu, pogodbenih pogojev in spremnih dokumentov, komisija maloprodajnega subjekta v skladu s potrjenim standardnim operativnim postopkom sestavi akt, ki je podlaga za reklamacijo. dobavitelju (sestava akta enostransko s strani materialno odgovorne osebe je možna s soglasjem dobavitelja ali brez njegovega predstavnika).
Zapisnik se sestavi enostransko le v primeru, da se dobavitelj strinja z ugotovljeno neskladnostjo ali ni predstavnika dobavitelja.
Subjekt trgovine na drobno lahko v dogovoru z dobaviteljem odobri drugačen način obveščanja dobavitelja o neskladnosti dobavljenih farmacevtskih izdelkov s spremnimi dokumenti.
Ta možnost obveščanja mora biti odobrena tudi z internim ukazom organizacije in vključena v standardne operativne postopke.
Prej smo na splošno govorili o farmacevtskih izdelkih. Konkretno zdravila, ne glede na vir njihove dobave, so pod nadzorom sprejemljivosti, da bi preprečili, da bi ponarejena, podstandardna in ponarejena zdravila prišla v promet.
Sprejemna kontrola je sestavljena iz preverjanja prejetih zdravil z ocenjevanjem:
a) videz, barva, vonj;
b) celovitost embalaže;
c) skladnost označevanja zdravil z zahtevami, ki jih določa zakonodaja o prometu z zdravili;
d) pravilna izvedba spremnih dokumentov;
e) prisotnost registra izjav, ki potrjujejo kakovost zdravil v skladu z veljavnimi regulativnimi dokumenti.
Treba je opozoriti, da se za izvajanje nadzora prevzema z notranjim ukazom vodje maloprodajnega subjekta ustanovi sprejemna komisija.
Člani komisije morajo biti seznanjeni z vsemi zakonodajnimi in drugimi regulativnimi pravnimi akti Ruske federacije, ki določajo osnovne zahteve za farmacevtske izdelke, izvedbo spremnih dokumentov in njihovo popolnost.
Podatki o sprejemnem nadzoru se odražajo v dnevniku, ki se vodi v prosti obliki in je lahko v tiskani in elektronski obliki.
Hranjenje kakršnega koli drugega dokumenta, ki potrjuje opravljanje prevzemne kontrole, po pravilih NAP ni potrebno.
Priprava pred prodajo.
Pred dobavo v prodajni prostor morajo farmacevtski izdelki opraviti predprodajno pripravo, ki vključuje:
- razpakiranje,
- sortiranje
- pregled,
- preverjanje kakovosti izdelka (po zunanjih znakih),
- preverjanje razpoložljivosti potrebnih informacij o izdelku in njegovem dobavitelju.
Medicinski, otroški in dietetični izdelki, biološko aktivni aditivi so živilski izdelki, ki jih je treba pred dobavo na trgovski prostor ali drug kraj trgovanja osvoboditi posod, ovojnih in vezivnih materialov ter kovinskih sponk.
Subjekt trgovine na drobno mora tudi na podlagi zunanjih znakov preverjati kakovost medicinskih, otroških in dietetičnih izdelkov, prehranskih dopolnil, preverjati razpoložljivost potrebne dokumentacije in informacij ter izvajati zavrnitev in sortiranje.
Trgovina z medicinskimi, otroškimi in dietetskimi izdelki, biološko aktivnimi dodatki je prepovedana, če je kršena celovitost embalaže.
Kakovost te skupine blaga potrjuje potrdilo o državni registraciji, ki navaja obseg uporabe in uporabe, ter dokument proizvajalca in (ali) dobavitelja, ki potrjuje varnost izdelka, izjavo o skladnosti kakovosti ali register izjav.
V primeru kršitve celovitosti embalaže ali pomanjkanja celotnega paketa dokumentov je treba medicinske, otroške in dietne izdelke, prehranska dopolnila vrniti dobavitelju.
Razkužila morajo pred dobavo v prodajni prostor ali namestitvijo na prodajno mesto opraviti predprodajno pripravo, ki vključuje:
- oprostitev transportne embalaže,
- sortiranje,
- preverjanje neoporečnosti embalaže (vključno z delovanjem aerosolne embalaže),
- preverjanje kakovosti blaga po zunanjih znakih,
- preverjanje razpoložljivosti potrebnih informacij o razkužilih in njihovem proizvajalcu,
- preverjanje navodil za uporabo.
Parfumski in kozmetični izdelki, dobavljeni v trgovinsko cono, morajo izpolnjevati zahteve, določene s Sklepom Komisije carinske unije z dne 23. septembra 2011 N 799 „O sprejetju tehničnih predpisov carinske unije „O varnosti parfumov in kozmetike“. izdelki«.
Shranjevanje.
Osnovni podatki o hrambi so navedeni v Civilnem fondu XIII, Red 706n in Red 646n. Vendar pravila NAP navajajo tudi nekatera pravila za shranjevanje, ki jih je treba upoštevati.
Po pravilih NAP je dovoljeno javno razstavljanje zdravil brez recepta in drugih lekarniških izdelkov (skladno s tem odprto razstavljanje ne velja za zdravila na recept).
Zdravila, ki se prodajajo brez recepta, so postavljena na vitrine ob upoštevanju pogojev shranjevanja, določenih v navodilih za medicinsko uporabo in (ali) na embalaži.
Zdravila na recept se lahko hranijo v vitrinah, v steklenih in odprtih omarah, če kupci nimajo dostopa do njih.
Zdravila na recept so shranjena ločeno od zdravil brez recepta v zaklenjenih omaricah z oznako "zdravilo na recept" na polici ali omari, v kateri so takšna zdravila.
Izvedba.
Trgovina na drobno s farmacevtskimi izdelki obsega prodajo, izdajo in farmacevtsko svetovanje.
Za opravljanje farmacevtsko svetovalnih storitev je dovoljeno dodeliti poseben prostor, tudi za čakanje potrošnikov, z namestitvijo ali določitvijo posebnih omejevalnikov in organizacijo sedežev.
Vodja lekarniške organizacije, samostojni podjetnik posameznik, zagotavlja razpoložljivost minimalnega asortimana.
V nakupovalnem prostoru, na priročnem mestu za ogled, se nahajajo:
a) kopijo dovoljenja za opravljanje lekarniške dejavnosti;
b) kopijo dovoljenja za promet s prepovedanimi drogami, psihotropnimi snovmi in njihovimi predhodnimi sestavinami, gojenje prepovedanih rastlin (če je na voljo);
c) informacije o nemožnosti vračila in zamenjave farmacevtskega blaga ustrezne kakovosti;
d) druge dokumente in informacije, s katerimi je treba seznaniti kupce.
Vsak maloprodajni subjekt mora imeti knjigo ocen in predlogov, ki jo kupec izroči na njegovo zahtevo (kar ne pomeni njene obvezne postavitve na stojnico).
Podatki o zdravilih brez recepta so lahko postavljeni na polico v obliki plakata, voblerja in drugih informacijskih medijev, da bi kupcu omogočili ozaveščeno izbiro lekarniškega izdelka, pridobitev informacij o proizvajalcu. , način uporabe in za ohranitev videza izdelka.
Prav tako je treba na primernem mestu za ogled postaviti ceno, ki označuje:
- imena,
- odmerki,
- število odmerkov v pakiranju,
- država izvora,
- rok uporabe (če je na voljo).
(Glavne zahteve za cenovne oznake so določene tudi v Odloku Vlade Ruske federacije z dne 19. januarja 1998 N55 »O odobritvi Pravil za prodajo nekaterih vrst blaga, seznam trajnega blaga, ki ni pod pogojem, da kupec zahteva, da mu brezplačno zagotovi za čas popravila ali zamenjavo podobnega izdelka, in seznam neživilskih izdelkov dobre kakovosti, ki jih ni mogoče vrniti ali zamenjati za podoben izdelek druge velikosti, oblike, velikost, slog, barva ali konfiguracija").
Farmacevtski delavec pri prodaji zdravil nima pravice kupcu prikrivati podatkov o razpoložljivosti drugih zdravil z enakim mednarodnim nelastniškim imenom in njihovih cenah glede na zahtevano.
Promet na drobno s farmacevtskimi izdelki, ki niso povezani z zdravili, lahko opravljajo delavci, ki nimajo farmacevtske izobrazbe ali dodatne strokovne izobrazbe iz trgovine na drobno z zdravili, če delajo v ločenih oddelkih (ambulante, ambulante, bolnišnične in bolniško-porodniške postaje). , centri (oddelki) ) splošna zdravstvena (družinska) praksa) zdravstvene organizacije, ki imajo dovoljenje za opravljanje farmacevtske dejavnosti in se nahajajo na podeželju, kjer ni lekarn.
Na zahtevo kupca ga mora farmacevtski delavec seznaniti s priloženo dokumentacijo za izdelek, ki za vsako ime izdelka vsebuje podatke o obvezni potrditvi skladnosti v skladu z zakonodajo Ruske federacije o tehničnih predpisih.
- potrdilo o skladnosti,
- njegovo številko,
- rok njegove veljavnosti,
- organ, ki je potrdilo izdal, oz
- podatke o izjavi o skladnosti,
- vključno z registrsko številko,
- rok njegove veljavnosti,
- ime osebe, ki je deklaracijo sprejela, in
- organ, ki ga je registriral.
Ti dokumenti morajo biti overjeni s podpisom in žigom (če obstaja) dobavitelja ali prodajalca z navedbo naslova njegove lokacije in kontaktne telefonske številke.
Kontrola kakovosti.
Vodja maloprodajnega subjekta mora spremljati količinske in kvalitativne parametre kupljenih farmacevtskih izdelkov, pa tudi čas njihove dostave v skladu s pogodbami, sklenjenimi v skladu z zahtevami zakonodaje Ruske federacije.
Vodja maloprodajnega subjekta mora zagotoviti identifikacijo farmacevtskih izdelkov, ki ne izpolnjujejo zahtev regulativne dokumentacije, da se prepreči njihova nenamerna uporaba ali prodaja.
Ponarejene, podstandardne, ponarejene farmacevtske izdelke je treba identificirati in izolirati od drugih farmacevtskih izdelkov v skladu s standardnimi operativnimi postopki.
Označevanje, lokacija in metode razmejitve karantenskega območja ter oseba, odgovorna za delo z navedenimi farmacevtskimi izdelki, so določeni z odredbo vodje maloprodajnega subjekta.
Vodja maloprodajnega subjekta opravi oceno dejavnosti, da preveri popolnost izpolnjevanja zahtev, določenih s tem pravilnikom, in določi korektivne ukrepe.
V. Notranja revizija (pomagala vam bo pravilno organizirati delo brez kršitev in preprečiti napake)
Notranja revizija se izvaja za odkrivanje pomanjkljivosti v skladu z zahtevami zakonodaje Ruske federacije in dajanje priporočil za korektivne in preventivne ukrepe.
Program notranje revizije bi moral upoštevati rezultate predhodnih notranjih presoj in inšpekcijskih pregledov regulativnih organov.
Notranjo revizijo morajo neodvisno in skrbno izvajati osebe, ki jih posebej imenuje vodja maloprodajnega subjekta, ki so zaposlene v maloprodajnem subjektu in (ali) pogodbeno angažirane (kar je določeno tudi z internim naročilo).
Po odločitvi vodje maloprodajnega subjekta se lahko izvede neodvisna revizija, vključno s strokovnjaki tretjih maloprodajnih subjektov.
Rezultati notranje revizije so dokumentirani. Dokumenti, sestavljeni kot rezultat revizije, morajo vsebovati vse pridobljene podatke in predloge potrebnih korektivnih ukrepov. Izvedeni ukrepi na podlagi rezultatov notranje revizije so tudi dokumentirani.
Tako glavne informacije, ki jih morajo vsebovati dokumenti notranje revizije, vključujejo naslednje postavke:
- kdo izvaja revizijo;
- kdaj se opravi revizija;
- revizijski program;
- kaj je bilo ugotovljeno med notranjo revizijo;
- sprejetih ukrepih na podlagi rezultatov notranje revizije.
Odgovorna oseba za področje dejavnosti subjekta trgovine na drobno, ki se pregleduje, mora zagotoviti takojšnje izvajanje korektivnih in preventivnih ukrepov.
Nadaljnji ukrepi morajo vključevati revizijo izvedenih korektivnih in preventivnih ukrepov ter poročilo o rezultatih sprejetih ukrepov in njihovi učinkovitosti.
Vodja maloprodajnega subjekta mora nenehno izboljševati učinkovitost sistema kakovosti, med drugim z uporabo rezultatov notranje presoje, analize podatkov, korektivnih in preventivnih ukrepov.
za študente 4. letnika Fakultete za farmacijo in FPIG na temo lekcije:
Nabavna in prodajna politika lekarniške organizacije
Načrtujte
Cilji in cilji nabavne politike lekarniške organizacije. Oblikovanje trga za trgovske ponudbe.
Vloga trgovskih posrednikov pri distribuciji blaga.
Nabavna dejavnost lekarniške organizacije: dokumentacija nabavnega poslovanja. dogovor. Struktura pogodbe.
Prodajna strategija lekarniške organizacije. Program FOSSTIS.
Cilji in cilji nabavne politike lekarniške organizacije. Oblikovanje trga za trgovske ponudbe
Glavna naloga lekarniških organizacij je nemoteno zagotavljanje prebivalstva in zdravstvenih organizacij z učinkovitimi, varnimi in kakovostnimi zdravili, medicinskimi izdelki, medicinsko opremo in drugimi farmacevtskimi izdelki. Po drugi strani pa je namen dejavnosti, tako kot vsaka gospodarska organizacija, ustvarjanje dobička. V zvezi s tem je treba posebno pozornost nameniti organizaciji distribucije izdelkov, oblikovanju nabavne dejavnosti in prodajne politike organizacije ter hitremu odzivanju na spremembe povpraševanja potrošnikov.
Osnova politiko javnih naročil– učinkovitost in pravočasnost dostave blaga. Učinkovitost nabavne politike razumemo kot širitev obsega dejavnosti, zagotavljanje močnega konkurenčnega položaja organizacije na trgu in doseganje ciljnih dobičkov z optimizacijo stroškov nabave.
Za ocenjevanje učinkovitosti nabavne politike je priporočljivo uporabiti večkriterijski pristop, ki temelji na dejstvu, da je merilo učinkovitosti nabavne politike stopnja doseganja njenih ciljev. Cilje nabavne politike organizacij delimo v štiri glavne skupine: cilji kakovosti, stroškov, likvidnosti, zanesljivosti.
Cilji kakovosti navedite zahteve glede lastnosti kupljenega blaga. Ker je kakovost kupljenega blaga pogoj za zagotavljanje kakovosti prodanih izdelkov, ima ta cilj pri nabavi samostojen pomen. Kazalniki učinkovitosti nabavne politike pri doseganju cilja zagotavljanja zahtevane ravni kakovosti asortimana vključujejo: obseg maloprodajnega prometa, dinamiko maloprodajnega prometa, število sort sortimenta, stopnjo obnavljanja asortimana, stopnjo prometa. Pri obravnavi tega vidika nabavne politike je priporočljivo vključiti kot kazalnike kakovosti ne le raven kakovosti dobavljenih izdelkov, temveč tudi raven kakovosti storitev trgovske organizacije s strani dobavitelja, delež naročil, opravljenih v skladnost z zahtevami, progresivnost embalaže dobavljenih izdelkov ter raven kakovosti povezanih storitev.
Cilji optimizacija stroškov: ne upoštevajo le stroškov, ki jih povzročajo nabavne dejavnosti, ampak se upoštevajo v povezavi s skupnimi stroški organizacije. Kazalnika učinkovitosti nabavne politike pri doseganju cilja minimiziranja stroškov sta višina nabavnih stroškov in skupna raven stroškov distribucije.
Likvidnostni cilji so posledica potrebe po privabljanju finančnih sredstev za nakup blaga. Te obveznosti zmanjšujejo likvidnost organizacije, zato je treba upoštevati likvidnostne posledice nabave. Kazalniki uspešnosti doseganja določene stopnje likvidnosti so: kazalniki strukture obratnih sredstev, razmerje med obveznostmi in terjatvami ter kazalnik donosnosti obratnega kapitala.
Cilji zanesljivosti izhajajo iz dejstva, da morata biti funkciji dobave in prodaje usklajeni. Lahko se obravnava z različnih vidikov: zanesljivost dobaviteljev, zanesljivost storitev, zanesljivost skladiščnih in transportnih procesov itd. Indikatorji želene stopnje zanesljivosti dobave so: število dobaviteljev, delež dobaviteljev z blagovnimi znamkami, stopnja stabilnosti pri sklepanju pogodb, stopnja pripravljenosti dobavitelja za pravočasno dostavo; zanesljivost oskrbe; stopnja pripravljenosti za takojšnjo dostavo (delež celotnega povpraševanja po izdelkih, katerega zadovoljitev z dostavo se lahko izvede takoj), prilagodljivost dostave (pripravljenost podjetja, da izpolni spremembe naročila, ki jih je naredil potrošnik).
Glavni dejavniki, ki zmanjšujejo učinkovitost upravljanja nabavnih dejavnosti trgovinskih organizacij na sedanji stopnji, vključujejo:
Nestabilen finančni položaj trgovinskih organizacij;
Nizka kupna moč prebivalstva;
V nekaterih primerih je nezmožnost predvidevanja povpraševanja po določenih vrstah blaga, kar vodi do sprejemanja neutemeljenih vodstvenih odločitev na področju nabave blaga.
Eden najbolj obetavnih načinov za doseganje teh ciljev je diverzifikacija nabavnih dejavnosti. Diverzifikacija (novolat. diverzifikacija- sprememba, raznolikost; od lat. diversus- različne in facere- do) - razširitev palete izdelkov in preusmeritev prodajnih trgov, razvoj novih vrst proizvodnje, da bi povečali učinkovitost proizvodnje, pridobili gospodarske koristi in preprečili stečaj.
Kakšne so podobnosti in razlike med politikami, standardi in operativnimi postopki? Na to vprašanje ne zna odgovoriti vsak. Zdi se, da obstaja splošno razumevanje, a hudič je v podrobnostih in podrobnosti so tiste, ki na koncu ustvarijo razliko v razumevanju. Razlika v razumevanju pa ima za posledico neupravičena pričakovanja in izgubljen čas.
Politike, standardi in postopki. Kakšna je razlika?
Politiki
Politika je zbirka načel, ki jih podjetje upošteva pri svojih dejavnostih. Načela so pravzaprav pravila obnašanja, sprejeta v podjetju. Upam, da razumete, da prisotnost izraženega načela ne pomeni, da se ga strogo upošteva? Ker sem včasih opazil situacijo, ko sta oblikovanje politike in njeno izvajanje veljala za enaka. A to je povsem druga zgodba. Zaenkrat si bomo ogledali samo politike, standarde in postopke.
Vendar sem se oddaljil. Vrnimo se k politiki.
V pravilniku predpisana pravila ravnanja in odločanja se lahko nanašajo na različna področja delovanja. Na primer:
- Politika internega komuniciranja
- Politika kakovosti
- Politika storitev za stranke
- Politika varnosti informacij
- Politika finančnega upravljanja
- Politika vodenja poslovnih procesov
Vsak od zgornjih primerov opredeljuje želeno vedenje podjetja na določenem področju.
Izkazalo se je, da ima lahko podjetje veliko politik - eno politiko za vsako področje dejavnosti. V redu, koliko naj bi jih bilo v tem primeru? Za katera področja dejavnosti je treba oblikovati politike? Na to vprašanje je nemogoče odgovoriti nedvoumno. Dejstvo je, da se politike oblikujejo za tista področja, ki so ključna z vidika strategije podjetja. In vsak ima svojo strategijo. Torej samo vi lahko določite nabor in sestavo politik.
Za vsako ključno področje ni treba oblikovati politike. Povsem sprejemljiva je uporaba ene politike, ki bo vključevala potrebna načela iz različnih področij delovanja. Tako lahko preprosto ustvarite seznam ključnih operativnih vprašanj, oblikujete odgovore nanje in jih sestavite v korporativno politiko.
Dobra politika poleg odgovora na vprašanje, kako ravnati v tem ali onem primeru, daje odgovor na vprašanje, zakaj je to treba storiti.
V uspešnih podjetjih politike piše in sprejema upravni odbor ali sestanek vodstvenih delavcev, ker Navsezadnje so odgovorni za celotno podjetje in vsakega posameznega zaposlenega.
Vprašanje vodenja politike je bilo deležno precej pozornosti. In to je povsem upravičeno.
Mimogrede, če že uporabljate pravilnike v podjetju, se prepričajte, da obstaja ustrezen pravilnik, ki ureja spremembe vseh drugih. V nasprotnem primeru bo spreminjanje politik postalo kaotično in bo izničilo vsa prizadevanja za njihovo ustvarjanje. Ne pozabite, da se morajo s spremembo pravilnika strinjati in podpisati vsi, ki so pravilnik predhodno sprejeli.
Standardi
Medtem ko pravilniki pokrivajo vprašanja v celotnem podjetju, standardi vzpostavljajo pravila in postopke nadzora, ki pomagajo pri stalnem upoštevanju pravilnikov. Standardi so tisto, kar morajo storiti vsi zaposleni za izvajanje politik. Standard ureja določeno vprašanje, zato ima podjetje lahko (in najverjetneje tudi bo) veliko standardov. Na primer GOST. En GOST ureja samo eno vprašanje. Na primer, obstaja cel blok GOST-ov o delovni dokumentaciji za gradnjo. Toda za vsako posamezno vprašanje obstaja standard:
- Sistem projektne dokumentacije za gradnjo. Osnovne zahteve za projektno in delovno dokumentacijo
- Sistem projektne dokumentacije za gradnjo. Splošni podatki o delovnih risbah
- Sistem projektne dokumentacije za gradnjo. Specifikacije
- Sistem projektne dokumentacije za gradnjo. Simboli za cevovode sanitarnih sistemov
Za zgornji primer bo pravilnik obravnaval splošna vprašanja vodenja projektne dokumentacije za gradnjo, standardi pa bodo določali konkretna vprašanja.
Vendar pa v ruski realnosti obstaja izjema. Podjetja, ki delujejo mednarodno, so pogosto prisiljena upoštevati dva standarda računovodskega poročanja – RAS in MSRP. Ampak to je izjema.
Tehnični standardi vsebujejo specifikacije, ki jih različni proizvajalci uporabljajo za zagotovitev, da se komponente ali naprave lahko uporabljajo skupaj ali so združljive med seboj.
Standardi so lahko zelo specifični in veljajo le za eno podjetje. Toda vsak standard je oblikovan na podlagi najboljših izkušenj – izkušenj podjetja ali industrije. Pogosto so standardi iz nekaterih panog in področij prilagojeni drugim. Na primer varnostni standardi.
Pogosto so standardi usmerjeni v zagotavljanje varnosti zaposlenih ter zaščito fizičnih in informacijskih sredstev podjetja.
Skladnost s standardi je obvezna.
Tako kot politike mora tudi standarde upravljati skupina strokovnjakov v okviru standarda. Zato je povsem narobe, ko na primer kadrovska služba vodi standard za varstvo pri delu. In to ni najbolj "oster" primer.
Tudi spremembe standardov morajo biti urejene na jasen in razumljiv način.
Postopki
Lahko rečemo, da so postopki navodila, ki povedo, kako izvesti dejanja. Pravi standardi in postopki so medsektorski, tj. odražajo, kako naj se določene operacije izvajajo korak za korakom v širšem pogledu na politike in standarde. Postopke je mogoče uporabljati in upravljati lokalno, na primer v enem oddelku ali celo na enem delovnem mestu. Res je, da to ne pomeni, da lahko pride do sprememb v postopkih po drugačnih principih kot do sprememb v politikah in standardih. V vsakem primeru mora postopek spremembe vsebovati celovito analizo vpliva na rezultate in potek postopka. Postopek kot del procesa ima določen rezultat, ki ima stranko. To je treba upoštevati pri vodenju postopkov. Ne pozabite tudi na spoštovanje interesov udeležencev v postopku.
Za upravljanje postopkov ni treba vključiti najvišjih vodstvenih organov, kot je upravni odbor. Pri odobritvi postopkov pa morajo sodelovati zainteresirani predstavniki srednjega vodstva. Naj vas spomnim, da so postopki povezani z višjimi standardi in politikami, zato lahko spreminjanje postopkov vpliva na interese v obe smeri.
Postopek s procesnega vidika
Pri upravljanju poslovnih procesov je koncept postopka nekoliko drugačen od splošno sprejetega. Z našega vidika je postopek linearno zaporedje operacij. Postopek omogoča prikaz zaporedja dejanj v obliki enostavnega seznama in s tem poenostavitev opisa poslovnega procesa.
Skupni elementi
Splošne dokumentacijske zahteve povečujejo verjetnost pravilnega razumevanja in izvajanja dokumentov.
Jasnost
Politike, standardi in postopki morajo biti napisani v jasnem jeziku, ki ga vsi razumejo. To je obvezna in temeljna zahteva. Čeprav različni ljudje različno razumejo informacije, je pomembno zagotoviti, da so dokumenti razumljivi širokemu krogu uporabnikov. Osebno zahtevo formuliram takole: dokument mora biti razumljiv povprečnemu človeku na ulici. To pomeni, da mora strokovnjak, ki ima nabor osnovnih znanj na tem področju, zlahka razumeti, kaj je napisano v dokumentu in kaj z njim storiti.
Ta zahteva vključuje tudi uporabo čim bolj preprostega in živahnega jezika. Preprosteje kot je napisano, lažje ga zaznamo. Samo ne pozabite upoštevati slovničnih pravil.
Enotnost
Ne spreminjajte dokumentov v stripe. Ko raznolikost slik, pisav, barv in stilov oblikovanja začne zaslepiti vaše oči. Izberite preproste sloge in ohranite dosledne elemente. Če se za poudarjanje definicij uporablja krepka pisava, potem ni primerna za poudarjanje ključnih idej. Velikost naslovov mora biti enaka za ustrezno raven naslova. Ne delajte večbarvnih naslovov iste ravni itd.
Razmerje
V vsakem dokumentu je treba zaslediti povezavo med dokumenti. Z drugimi besedami, če postopek podpira izvajanje določenega standarda, ki posledično odraža delovanje politike, mora biti to jasno razvidno iz dokumenta. Sprememba postopka bo na koncu povzročila spremembo politike in obratno. V dokumentaciji mora obstajati hierarhija. Uporaba interaktivnih povezav zelo poenostavi proces dela z dokumentacijo.
Enojna shramba
Danes se mnoga podjetja soočajo z eno pomanjkljivostjo, povezano s shranjevanjem informacij – pomanjkanjem enotnega spletnega prostora za shranjevanje. Vse politike, standardi in postopki bi morali biti na enem mestu, do katerega bi imeli dostop zainteresirani zaposleni. Dostop mora biti berljiv, vendar ne sme biti urejen. Da, mogoče je (in včasih potrebno) razlikovati med pravicami do branja dokumentacije.
Urejanje dokumentacije je dovoljeno le odgovornim osebam. Pravice za spreminjanje dokumenta morajo biti konfigurirane tudi glede na pot odobritve. To pomeni, da se lahko dokument v spletni shrambi spremeni le, če se s tem strinjajo vsi odgovorni.
Iskanje po imenih dokumentov in njihovi vsebini mora delovati. Sistem označevanja je dobrodošel. Dokumentacijski zemljevid - akrobatika.
Razpoložljivost spremne dokumentacije
Ta vrsta dokumenta je pogosto pozabljena. Ta vrsta vključuje navodila, kontrolne liste, opise metod izračuna itd. Ti dokumenti so namenjeni pomoči zaposlenim pri izvajanju določenih procesov, postopkov itd. Zelo pogosto je pomanjkanje tehničnih navodil zelo resna ovira za uspešno izvedbo in učinkovito uporabo določenega orodja.
V drugem članku bom zagotovo govoril o celotni strukturi.
"O potrditvi pravil dobre lekarniške prakse zdravil za medicinsko uporabo"
Revizija z dne 31.08.2016 — Velja od 01.03.2017
MINISTRSTVO ZA ZDRAVJE RUSKE FEDERACIJE
NAROČITE
z dne 31. avgusta 2016 N 647n
O POTRDITVI PRAVIL DOBRE LEKARNIŠKE PRAKSE ZA ZDRAVILA ZA ZDRAVSTVENO UPORABO
1. Potrjuje priložena Pravila dobre lekarniške prakse za zdravila za medicinsko uporabo.
Vršilec dolžnosti ministra
I.N. KAGRAMANJAN
ODOBRENA
po odredbi Ministrstva za zdravje
Ruska federacija
z dne 31. avgusta 2016 N 647n
PRAVILA DOBRE LEKARNIŠKE PRAKSE ZA ZDRAVILA ZA MEDICINSKO UPORABO
I. Splošne določbe
1. Ta pravilnik dobre lekarniške prakse zdravil za medicinsko uporabo (v nadaljnjem besedilu: pravilnik, zdravila) določa zahteve za promet na drobno lekarniških organizacij, samostojnih podjetnikov posameznikov z dovoljenjem za opravljanje lekarniške dejavnosti, zdravniških organizacij z dovoljenjem za opravljanje farmacevtske dejavnosti. dejavnosti in njihove ločene enote (ambulante, ambulante, ambulante za zdravstveno nego in porodništvo, centri (oddelki) splošne zdravstvene (družinske) prakse), ki se nahajajo v podeželskih naseljih, v katerih ni lekarniške organizacije (v nadaljnjem besedilu: subjekti trgovine na drobno), pa tudi lekarniške organizacije in zdravstvene organizacije ali njihovi ločeni oddelki, ki se nahajajo v podeželskih naseljih in na območjih, oddaljenih od naseljenih območij, kjer ni lekarniških organizacij, če imajo lekarniške organizacije, zdravniške organizacije ali njihovi ločeni oddelki dovoljenje, ki ga določa zakonodaja. Ruske federacije o izdaji dovoljenj za nekatere vrste dejavnosti izdajanja zdravil za narkotike in psihotropnih zdravil posameznikom.
II. Kontrola kakovosti
3. Trgovina na drobno s farmacevtskimi izdelki se izvaja z izvajanjem sklopa ukrepov, namenjenih izpolnjevanju zahtev tega pravilnika, ki vključuje (v nadaljnjem besedilu: sistem kakovosti):
a) določanje procesov, ki vplivajo na kakovost storitev, ki jih opravlja maloprodajni subjekt in so namenjeni zadovoljevanju povpraševanja kupcev po farmacevtskih izdelkih, pridobivanje informacij o pravilih shranjevanja in uporabe zdravil, razpoložljivosti in ceni zdravila, vključno z prednostni postopek prejemanja informacij o razpoložljivosti zdravil nižjega cenovnega razreda (v nadaljnjem besedilu: lekarniške storitve);
b) vzpostavitev zaporedja in medsebojnega delovanja procesov, potrebnih za zagotavljanje sistema kakovosti, glede na njihov vpliv na varnost, učinkovitost in racionalnost uporabe zdravil;
c) določitev meril in metod, ki odražajo doseganje rezultatov, tako pri izvajanju procesov, potrebnih za zagotavljanje sistema kakovosti, kot pri njihovem upravljanju, ob upoštevanju zahtev zakonodaje Ruske federacije o prometu z zdravili. ;
d) določitev kvantitativnih in kvalitativnih parametrov, vključno z materialnimi, finančnimi, informacijskimi, delovnimi, potrebnimi za vzdrževanje procesov sistema kakovosti in njihovo spremljanje;
e) zagotavljanje prebivalstvu kakovostnih, varnih in učinkovitih farmacevtskih izdelkov;
f) sprejemanje ukrepov, potrebnih za doseganje načrtovanih rezultatov in nenehno izboljševanje kakovosti storitev za stranke ter večanje osebne odgovornosti zaposlenih.
4. Dokumentacijo sistema kakovosti vodijo delavci, ki jih pooblasti vodja maloprodajnega subjekta, na papirju in (ali) elektronskih medijih in med drugim vključuje:
a) dokument o usmeritvi in ciljih subjekta trgovine na drobno, ki opredeljuje načine za zagotavljanje povpraševanja kupcev po farmacevtskih izdelkih, zmanjšanje tveganja, da pridejo v javni promet nekakovostna, ponarejena in ponarejena zdravila, medicinski pripomočki in prehranska dopolnila;
b) priročnik o kakovosti, ki določa smeri razvoja maloprodajnega subjekta, tudi za določeno časovno obdobje, in vsebuje sklicevanja na zakonodajne in druge regulativne pravne akte, ki urejajo izvajanje farmacevtske dejavnosti;
c) dokumente, ki opisujejo postopek izvajanja farmacevtskih storitev trgovskega subjekta na drobno (v nadaljnjem besedilu: standardni poslovni postopki);
d) odredbe in navodila vodje maloprodajnega subjekta za glavno dejavnost;
e) osebne izkaznice zaposlenih v trgovskem subjektu;
f) dovoljenje za opravljanje lekarniške dejavnosti in priloge k njemu;
g) listine v zvezi s prekinitvijo (ponovnim začetkom) prometa farmacevtskih izdelkov, odpoklicem (umikom) zdravil iz prometa, ugotavljanjem primerov prometa neregistriranih medicinskih pripomočkov;
h) akti inšpekcijskih pregledov subjektov trgovine na drobno s strani uradnih oseb državnih kontrolnih (nadzornih) organov, občinskih nadzornih organov in notranjih revizij;
i) dokumente o učinkovitem načrtovanju dejavnosti, izvajanju procesov zagotavljanja sistema kakovosti in njihovem upravljanju.
5. Dokumenti o učinkovitem načrtovanju dejavnosti, izvajanju procesov za zagotavljanje sistema kakovosti in njihovem upravljanju glede na funkcije, ki jih izvaja maloprodajni subjekt, vključujejo:
a) organizacijska struktura;
b) notranji delovni red;
c) register registriranih cen zdravil, uvrščenih na listo nujnih in esencialnih zdravil;
d) opise delovnih mest z opombo o seznanitvi delavcev, ki zasedajo ustrezna delovna mesta;
e) dnevnik uvodnega sestanka o varstvu pri delu;
f) dnevnik registracije navodil na delovnem mestu;
g) dnevnik sestankov s požarno varnostjo;
h) dnevnik sestankov o električni varnosti;
i) dnevnik naročil (navodil) za trgovino na drobno;
j) dnevnik dnevne registracije parametrov temperature in vlažnosti v prostorih za shranjevanje zdravil, medicinskih pripomočkov in prehranskih dopolnil;
k) dnevnik periodičnega beleženja temperature v hladilni opremi;
l) dnevnik transakcij v zvezi s prometom zdravil, vključenih v seznam zdravil, ki so predmet predmetno-količinskega knjigovodstva (če obstajajo);
m) dnevnik inšpekcijskih pregledov pravne osebe, samostojnega podjetnika posameznika, ki jih izvajajo državni nadzorni (nadzorni) organi, občinski nadzorni organi (če obstajajo);
o) dnevnik izdajanja zdravil, ki so vključena v minimalni nabor zdravil, potrebnih za izvajanje zdravstvene oskrbe (v nadaljnjem besedilu: minimalni nabor), vendar v času prijave kupca niso na voljo;
o) dnevnik nepravilno napisanih receptov;
p) dnevnik za zdravila z omejenim rokom uporabnosti;
c) dnevnik napak;
r) laboratorijski dnevnik pakiranja;
s) evidenco transakcij v zvezi s prometom s prepovedanimi drogami, psihotropnimi snovmi in njihovimi predhodnimi sestavinami (če obstajajo);
t) dnevnik za evidentiranje rezultatov prevzemne kontrole;
x) dnevnik prevzema in porabe cepiv (če je na voljo);
v) dnevnik receptov, ki so bili (so) na odloženem servisu (če obstajajo);
h) revija informacijskega dela z zdravniškimi organizacijami o postopku za brezplačno oskrbo določenih kategorij državljanov z zdravili in medicinskimi izdelki ter prodajo zdravil in medicinskih izdelkov s popustom.
Vodja maloprodajnega subjekta ima pravico odobriti druge vrste in oblike revij.
6. Vodja maloprodajnega subjekta imenuje osebe, odgovorne za vzdrževanje in shranjevanje dokumentov, navedenih v odstavkih 4 in 5 tega pravilnika, zagotavljanje dostopa do njih in po potrebi njihovo obnovitev.
Obdobje hrambe teh dokumentov je določeno v skladu z zahtevami zakonodaje Ruske federacije o arhivskih zadevah.
III. Vodja maloprodajnega subjekta
7. Vodja subjekta trgovine na drobno zagotavlja:
a) seznanjanje delavcev s tem pravilnikom in njihovo skladnost, seznanjanje delavcev z njihovimi pravicami in dolžnostmi, določenimi z opisom delovnih mest in strokovnimi standardi;
b) določanje usmeritve in ciljev dejavnosti za zadovoljevanje povpraševanja kupcev po farmacevtskih izdelkih, zmanjševanje tveganj za vstop nekakovostnih, ponarejenih in ponarejenih zdravil, medicinskih pripomočkov in prehranskih dopolnil v javni promet ter učinkovito interakcijo med zdravstvenim delavcem, farmacevtski delavec in kupec;
c) zmanjševanje proizvodnih izgub, optimizacija dejavnosti, povečanje blagovne menjave, povečanje ravni znanja in usposobljenosti farmacevtskih delavcev;
d) analiziranje skladnosti s politikami in poslovnimi cilji, poročila notranje revizije in zunanje inšpekcije z namenom izboljšanja opravljenih farmacevtskih storitev;
e) potrebna sredstva za delovanje vseh procesov maloprodajnega subjekta za izpolnjevanje zahtev za izdajo dovoljenj, sanitarnih in epidemioloških zahtev, pravil o zdravju in varnosti pri delu, požarnih predpisov in drugih zahtev, ki jih določa zakonodaja Ruske federacije;
f) razvoj aktivnosti za spodbujanje in motiviranje aktivnosti zaposlenih;
g) odobritev standardnih operativnih postopkov;
h) vzpostavitev internega postopka za izmenjavo informacij, vključno z informacijami v zvezi z delovanjem sistema kakovosti, tudi z uporabo pisne oblike (seznanilni list), oglasnimi stojnicami na javnih mestih, informativnimi sestanki z določeno frekvenco, elektronska distribucija informacij na elektronski naslov;
i) razpoložljivost informacijskih sistemov, ki omogočajo izvajanje dejavnosti v zvezi z distribucijo blaga in identifikacijo ponarejenih, ponarejenih in podstandardnih zdravil.
8. Vodja maloprodajnega subjekta za zagotavljanje nemotene oskrbe kupcev s farmacevtskim blagom organizira:
a) zagotavljanje sistema javnih naročil, ki preprečuje distribucijo ponarejenih, podstandardnih, ponarejenih farmacevtskih izdelkov;
b) opremljanje prostorov z opremo, ki zagotavlja pravilno ravnanje s farmacevtskimi izdelki, vključno z njihovim skladiščenjem, računovodstvom, prodajo in izdajo;
d) obveščanje kupcev o razpoložljivosti blaga, vključno z zdravili nižjega cenovnega razreda.
9. Vodja maloprodajnega subjekta obvešča zaposlene o naslednjih informacijah:
a) o spremembah zakonodaje Ruske federacije, ki ureja pravna razmerja, ki izhajajo iz prometa farmacevtskih izdelkov, vključno s spremembami pravil za izdajo zdravil;
b) o rezultatih notranjih in zunanjih presoj;
c) o potrebnih preventivnih in korektivnih ukrepih za odpravo (preprečevanje) kršitev licenčnih zahtev;
d) o rezultatih obravnave pritožb in predlogov strank.
10. Vodja maloprodajnega subjekta, ob upoštevanju zahtev delovne zakonodaje in drugih regulativnih pravnih aktov, ki vsebujejo norme delovnega prava, je imenovana oseba, odgovorna za izvajanje in zagotavljanje sistema kakovosti (v nadaljnjem besedilu: odgovorna oseba).
11. Vodja maloprodajnega subjekta analizira sistem kakovosti v skladu z urnikom, ki ga odobri.
Analiza vključuje oceno možnosti izboljšav in potrebe po spremembah organizacije sistema kakovosti, vključno s usmeritvami in cilji delovanja, in se izvaja z upoštevanjem rezultatov notranjih presoj (inšpekcij), knjige recenzije in predlogi, vprašalniki, ustne želje kupcev (povratne informacije kupca), sodobni dosežki znanosti in tehnike, članki, ocene in drugi podatki.
Na podlagi rezultatov analize sistema kakovosti lahko vodja maloprodajnega subjekta odloči o potrebi in (ali) smiselnosti povečanja učinkovitosti sistema kakovosti in njegovih procesov, izboljšanja kakovosti farmacevtskih storitev, sprememb v potrebe po virih (materialnih, finančnih, delovnih in drugih), potrebnih investicijah za izboljšanje storitev za stranke, sistemih motiviranja zaposlenih, dodatnem izobraževanju (inštrukcijah) zaposlenih in drugih rešitvah.
IV. Osebje
12. Za izpolnjevanje zahtev, določenih s tem pravilnikom, mora imeti subjekt trgovine na drobno glede na obseg farmacevtskih storitev, ki jih opravlja, potrebno osebje.
Vodja maloprodajnega subjekta potrdi kadrovsko tabelo, ki vsebuje seznam strukturnih enot, imena delovnih mest, posebnosti, poklice z navedbo kvalifikacij, podatke o številu osebja in skladu plač.
Vsak zaposleni mora biti seznanjen s svojimi pravicami in dolžnostmi, ki jih določajo opisi delovnih mest in poklicni standardi.
13. Zaposleni, ki opravljajo dela, ki vplivajo na kakovost izdelkov, morajo imeti potrebne kvalifikacije in delovne izkušnje za izpolnjevanje zahtev, določenih s tem pravilnikom.
14. Za novo zaposlene delavce se v skladu z lokalnimi predpisi trgovskega subjekta izvaja prilagoditveni program in se redno preverja usposobljenost, znanje in izkušnje teh delavcev.
Prilagoditveni program med drugim vključuje:
a) uvajalno usposabljanje ob zaposlitvi;
b) usposabljanje (inštrukcije) na delovnem mestu (začetno in ponavljajoče);
c) obnavljanje znanja:
zakonodaja Ruske federacije na področju prometa zdravil in varstva javnega zdravja, varstva pravic potrošnikov;
pravila osebne higiene;
o postopku opravljanja farmacevtskih storitev, vključno s farmacevtskim svetovanjem in uporabo zdravil na domu;
d) razvoj komunikacijskih veščin in preprečevanje konfliktov;
e) navodila o varnosti in varstvu pri delu.
15. Glavne naloge farmacevtskih delavcev so:
a) prodaja farmacevtskega blaga ustrezne kakovosti;
b) zagotavljanje zanesljivih informacij o farmacevtskih izdelkih, njihovih stroških, farmacevtsko svetovanje;
c) informacije o smotrni uporabi zdravil za namen odgovornega samozdravljenja;
d) proizvodnjo zdravil po receptih za zdravila in zahtevah računov zdravniških organizacij;
e) priprava knjigovodske dokumentacije;
f) spoštovanje poklicne etike.
16. Zahteve glede usposobljenosti in delovnih izkušenj vodje subjekta trgovine na drobno in njegovih farmacevtskih delavcev določa Pravilnik o izdaji dovoljenj za lekarniško dejavnost.<1>.
<1>Odlok Vlade Ruske federacije z dne 22. decembra 2011 N 1081 "O izdaji dovoljenj za farmacevtske dejavnosti" (Zbirka zakonodaje 2012, N 1, čl. 126; 2012, N 37, čl. 5002; 2013, N 16, čl. 1970; 2016, N 40, člen 5738).
17. Vodja maloprodajnega subjekta zagotavlja, da se začetno in nadaljnje usposabljanje (poučevanje) zaposlenih o naslednjih vprašanjih izvaja v skladu z urnikom, ki ga odobri:
a) pravila za izdajo zdravil za medicinsko uporabo;
b) pravila za izdajo prepovedanih drog in psihotropnih snovi, registriranih kot zdravila, zdravil, ki vsebujejo prepovedane droge in psihotropne snovi;
c) pravila za izdajo zdravil, ki so predmet predmetnega kvantitativnega knjigovodstva, pravila za vodenje dnevnika zdravil, ki so predmet predmetnega količinskega knjigovodstva;
d) pravila za izdajo zdravil, ki vsebujejo majhne količine prepovedanih drog;
e) postopek shranjevanja receptov;
f) izpolnjevanje zahtev glede razpoložljivosti minimalnega asortimana;
g) izpolnjevanje zahtev dobre prakse za shranjevanje in transport zdravil;
h) uporabo določenih najvišjih zneskov maloprodajnih pribitkov na dejanske prodajne cene proizvajalcev za zdravila, uvrščena na seznam nujnih in esencialnih zdravil, postopek oblikovanja cen teh zdravil;
i) izpolnjevanje zahtev za delo s ponarejenimi, nekakovostnimi, ponarejenimi farmacevtskimi izdelki;
j) upoštevanje omejitev, ki veljajo za farmacevtske delavce pri opravljanju njihove poklicne dejavnosti;
k) izboljšanje znanja o zdravilih, vključno z generičnimi zdravili, medsebojno zamenljivimi zdravili, zmožnosti podajanja primerjalnih informacij o zdravilih in cenah, tudi o zdravilih nižjega cenovnega razreda, o novih zdravilih, oblikah zdravil, indikacijah za uporabo zdravil;
l) načine obdelave podatkov, prejetih od kupcev o vprašanjih uporabe zdravil, ugotovljenih med uporabo, stranskih učinkih in posredovanje teh informacij zainteresiranim stranem;
m) skladnost z zahtevami varstva pri delu.
V. Infrastruktura
18. Vodja maloprodajnega subjekta zagotavlja in vzdržuje v stanju infrastrukturo, potrebno za izpolnjevanje licenčnih pogojev za opravljanje lekarniške dejavnosti, ki vključuje:
a) zgradbe, delovni prostor in pripadajoča delovna oprema;
b) oprema za procese (strojna in programska oprema);
c) podporne storitve (transportni, komunikacijski in informacijski sistemi).
19. Prostori in oprema morajo biti nameščeni, opremljeni in upravljani tako, da so primerni za opravljene funkcije. Njihova postavitev in zasnova morata zmanjšati tveganje napak in omogočiti učinkovito čiščenje in vzdrževanje, da se prepreči nabiranje prahu ali umazanije ter kakršnih koli dejavnikov, ki bi lahko negativno vplivali na kakovost farmacevtskih izdelkov.
20. Vsi prostori maloprodajnega subjekta morajo biti nameščeni v stavbi (zgradbi) in funkcionalno združeni, izolirani od drugih organizacij in zagotavljati odsotnost nepooblaščenega dostopa do prostorov s strani nepooblaščenih oseb. Vstop (izstop) na ozemlje maloprodajnega subjekta je dovoljen skozi prostore druge organizacije.
21. Subjekt trgovine na drobno mora zagotoviti možnost ureditve nemotenega vstopa in izstopa invalidov v skladu z zahtevami zakonodaje o varstvu invalidov.
Če konstrukcijska značilnost stavbe ne omogoča ureditve vhoda in izhoda za invalide, mora trgovski subjekt organizirati možnost klicanja farmacevta za oskrbo teh oseb.
22. Subjekt trgovine na drobno mora imeti znak, ki označuje:
a) vrsta lekarniške organizacije v ruskem in državnih jezikih: "Lekarna" ali "Lekarniška točka" ali "Lekarniški kiosk";
b) polno in (če obstaja) skrajšano firmo, vključno s firmo ter organizacijsko in pravno obliko subjekta trgovine na drobno;
c) način delovanja.
Subjekt trgovine na drobno, ki prodaja zdravila ponoči, mora imeti svetlobno tablo z obvestilom o delu ponoči.
Kadar se trgovski subjekt nahaja v stavbi, mora biti znak nameščen na zunanji steni stavbe, če to ni mogoče, je dovoljeno namestiti znak, katerega zahteve so podobne zahtevam za znak. .
23. Prostori morajo izpolnjevati sanitarne in higienske standarde in zahteve ter zagotavljati sposobnost opravljanja glavnih funkcij maloprodajnega subjekta v skladu z zahtevami, odobrenimi s tem pravilnikom.
24. Območje prostorov, ki jih uporablja maloprodajni subjekt, mora biti razdeljeno na območja, namenjena opravljanju naslednjih funkcij:
a) trgovina s farmacevtskimi izdelki z zagotavljanjem skladiščnih mest, ki ne omogočajo prostega dostopa kupcev do prodanega blaga, vključno s tistimi na recept;
b) sprejem farmacevtskega blaga, prostor za karantensko skladiščenje, vključno ločeno za zdravila;
c) ločeno skladiščenje delavskih oblačil.
Če se maloprodajni subjekt nahaja v stavbi skupaj z drugimi organizacijami, je dovoljena skupna uporaba kopalnice.
25. Prisotnost drugih con in (ali) prostorov v prostorih maloprodajnega subjekta določi vodja maloprodajnega subjekta, odvisno od obsega opravljenega dela in opravljenih storitev.
26. Prostori maloprodajnega subjekta morajo biti opremljeni s sistemi ogrevanja in klimatizacije (če obstajajo), naravnim ali prisilnim prezračevanjem (če obstajajo), ki zagotavljajo delovne pogoje v skladu z delovno zakonodajo Ruske federacije, kot tudi kot skladnost z zahtevami dobre prakse za shranjevanje in transport zdravil zdravil.
27. Materiali, uporabljeni pri zaključku in (ali) popravilu prostorov (območij), morajo izpolnjevati zahteve požarne varnosti, ki jih določa zakonodaja Ruske federacije.
Prostori trgovskega subjekta morajo biti načrtovani in opremljeni tako, da so zaščiteni pred vdorom žuželk, glodalcev ali drugih živali.
V prostorih maloprodajnega subjekta, namenjenega izdelavi zdravil, morajo biti površine sten in stropov gladke, brez poseganja v celovitost prevleke (vodoodporne barve, emajli ali svetle glazirane ploščice), obdelane z materiali, ki omogočiti mokro čiščenje z uporabo razkužil (neglazirane keramične ploščice, linolej z obveznim varjenjem šivov ali drugih materialov).
Stičišče sten s stropom in tlemi ne sme imeti vdolbin, izboklin ali vogalov.
28. Prostori subjekta trgovine na drobno imajo lahko naravno in umetno razsvetljavo. V vseh prostorih je treba zagotoviti splošno umetno razsvetljavo, za posamezna delovna mesta, če je potrebno, lokalno umetno razsvetljavo.
29. Subjekt trgovine na drobno mora imeti opremo in inventar, ki zagotavljata ohranjanje kakovosti, učinkovitosti in varnosti farmacevtskih izdelkov.
30. Prostori za shranjevanje zdravil morajo biti opremljeni z opremo, ki omogoča njihovo shranjevanje ob upoštevanju zahtev dobre prakse za shranjevanje in transport zdravil.
Prostori in oprema, ki jih uporablja maloprodajni subjekt pri opravljanju dejavnosti, morajo izpolnjevati sanitarne zahteve požarne varnosti, pa tudi varnostne predpise v skladu z zakonodajo Ruske federacije.
31. Oprema mora biti nameščena na razdalji najmanj 0,5 metra od sten ali druge opreme, da se omogoči dostop za čiščenje, dezinfekcijo, popravilo, vzdrževanje, preverjanje in (ali) kalibracijo opreme, da se zagotovi dostop do farmacevtskih izdelkov, brezplačen prehodni delavci.
Oprema ne sme ovirati naravnih ali umetnih virov svetlobe ali ovirati prehodov.
32. Dostop do prostorov (območij) imajo samo osebe, ki jih pooblasti vodja maloprodajnega subjekta. Dostop nepooblaščenim osebam v te prostore je prepovedan.
33. Oprema, ki jo uporablja maloprodajni subjekt, mora imeti tehnične potne liste, ki se hranijo za celotno obdobje delovanja opreme.
Oprema, ki jo uporablja subjekt trgovine na drobno in je povezana z merilnimi instrumenti, pred zagonom, pa tudi po popravilu in (ali) vzdrževanju, je predmet začetnega preverjanja in (ali) kalibracije, med delovanjem pa - rednega preverjanja in (ali) kalibracije v v skladu z zahtevami zakonodaje Ruske federacije za zagotovitev enotnosti meritev.
34. Maloprodajni prostori in (ali) območja morajo biti opremljeni z vitrinami, stojali (gondolami) - z odprtim prikazom blaga, ki zagotavlja pregled lekarniških izdelkov, dovoljenih za prodajo, in zagotavlja enostavno uporabo za zaposlene v subjekt trgovine na drobno.
Dovoljeno je odprto razstavljanje zdravil brez recepta in drugih lekarniških izdelkov.
35. Podatki o zdravilih brez recepta so lahko postavljeni na polico v obliki plakata, voblerja in drugih informacijskih medijev, da se kupcu omogoči ozaveščena izbira lekarniškega izdelka, pridobi informacije o proizvajalca, način njegove uporabe in ohranitev zunanjega tipa izdelka. Prav tako je treba na primernem mestu za ogled postaviti ceno, ki označuje ime, odmerek, število odmerkov v paketu, državo izvora, rok uporabnosti (če je na voljo).
36. Zdravila, ki se prodajajo brez recepta, so nameščena na vitrinah ob upoštevanju pogojev shranjevanja, določenih v navodilih za medicinsko uporabo in (ali) na embalaži.
Zdravila na recept se lahko hranijo v vitrinah, v steklenih in odprtih omarah, če kupci nimajo dostopa do njih.
Zdravila na recept so shranjena ločeno od zdravil brez recepta v zaklenjenih omaricah z oznako "zdravilo na recept" na polici ali omari, v kateri so takšna zdravila.
VI. Procesi dejavnosti subjekta trgovine na drobno s farmacevtskimi izdelki
37. Vsi procesi maloprodajnega subjekta, ki vplivajo na kakovost, učinkovitost in varnost farmacevtskih izdelkov, potekajo v skladu z odobrenimi standardnimi operativnimi postopki.
38. Vodja lekarniške organizacije, samostojni podjetnik posameznik, ki ima dovoljenje za lekarniško dejavnost, zagotavlja razpoložljivost minimalnega asortimana.
39. Vodja maloprodajnega subjekta mora spremljati količinske in kvalitativne parametre kupljenih farmacevtskih izdelkov ter njihove dobavne roke v skladu s pogodbami, sklenjenimi v skladu z zahtevami zakonodaje Ruske federacije.
40. Vodja subjekta trgovine na drobno mora odobriti postopek izbire in ocenjevanja dobaviteljev farmacevtskih izdelkov, pri čemer mora med drugim upoštevati naslednja merila:
a) skladnost dobavitelja z zahtevami veljavne zakonodaje Ruske federacije o licenciranju določenih vrst dejavnosti;
b) poslovni ugled dobavitelja na farmacevtskem trgu, ki temelji na prisotnosti dejstev odpoklica ponarejenih, podstandardnih, ponarejenih farmacevtskih izdelkov, neizpolnjevanja sprejetih pogodbenih obveznosti, odredb pooblaščenih državnih nadzornih organov o dejstvih kršitve zahtev zakonodaja Ruske federacije;
c) povpraševanje po farmacevtskih izdelkih, ki jih dobavitelj ponuja za nadaljnjo prodajo, skladnost kakovosti farmacevtskih izdelkov z zahtevami zakonodaje Ruske federacije;
d) skladnost dobavitelja z zahtevami, določenimi s tem pravilnikom za pripravo dokumentacije, razpoložljivost dokumenta s seznamom izjav o skladnosti izdelkov z uveljavljenimi zahtevami, protokol za dogovor o cenah za zdravila, vključena v seznam vitalna in esencialna zdravila;
e) skladnost dobavitelja s temperaturnimi pogoji med prevozom termolabilnih zdravil, vključno z imunobiološkimi zdravili;
f) zagotavljanje garancije kakovosti s strani dobavitelja za dobavljene farmacevtske izdelke;
g) konkurenčnost pogodbenih pogojev, ki jih ponuja dobavitelj;
h) ekonomsko izvedljivost pogojev dobave blaga, ki jih predlaga dobavitelj (število dobavljenih paketov, minimalni znesek dostave);
i) zmožnost dobave široke ponudbe;
j) skladnost dobavnega roka z delovnim časom maloprodajnega subjekta.
41. Maloprodajni subjekt in dobavitelj skleneta pogodbo ob upoštevanju zahtev zakonodaje o osnovah državne ureditve trgovinske dejavnosti v Ruski federaciji, pa tudi ob upoštevanju zahtev civilne zakonodaje, ki določajo rok, v katerem dobavitelj sprejme reklamacijo o kakovosti izdelka, kot tudi možnost vračila ponarejenega, nekakovostnega, ponarejenega asortimana farmacevtskega blaga dobavitelju, če je bila informacija o tem prejeta po prevzemu blaga in izvedbi ustreznih dokumenti.
42. V zvezi s farmacevtskimi izdelki (razen medicinskih izdelkov) lahko trgovec na drobno opravlja storitve dobavitelju na podlagi povračil, katerih predmet je izvajanje dejavnosti, ki so ekonomsko koristne za dobavitelja in prispevajo k povečanju prodaje. lekarniških izdelkov (razen medicinskih izdelkov) in zvestobe kupcev.
Dobavitelj se samostojno odloči, ali mora tovrstne storitve kupiti, vsiljevanje storitev dobavitelju s strani maloprodajnega subjekta pa ni dovoljeno.
43. Nakup farmacevtskega blaga s strani maloprodajnega subjekta, ustanovljenega v obliki državnega in občinskega enotnega podjetja, se izvaja v skladu z zahtevami zakonodaje Ruske federacije o pogodbenem sistemu na področju nabave blaga, dela, storitve za zadovoljevanje državnih in občinskih potreb.
44. V postopku prevzema farmacevtskega blaga, vključno s tistim, ki zahteva posebne pogoje skladiščenja in varnostne ukrepe, se upošteva skladnost prevzetega blaga z odpremno dokumentacijo glede sortimenta, količine in kakovosti, skladnost s posebnimi pogoji skladiščenja (če obstajajo). zahteva), kot tudi preverjanje poškodovanosti se izvaja transportna posoda.
Pristojnost subjekta trgovine na drobno za preverjanje kakovosti dobavljenega farmacevtskega blaga je omejena na vizualni pregled videza, preverjanje skladnosti s spremnimi dokumenti, popolnost kompleta spremnih dokumentov, vključno z registrom listin, ki potrjujejo kakovost farmacevtskega blaga. . Subjekt trgovine na drobno mora upoštevati posebnosti prevzema in predprodajnega pregleda farmacevtskih izdelkov.
45. Prevzem farmacevtskega blaga opravi materialno odgovorna oseba. Če so farmacevtski izdelki v transportni embalaži nepoškodovani, se lahko prevzem izvede po številu mest ali po številu enot izdelka in oznakah na embalaži. Če se dejanska razpoložljivost farmacevtskega blaga v posodah ne preverja, je treba o tem narediti opombo v spremni dokument.
46. Če količina in kakovost farmacevtskih izdelkov ustrezata tistim, navedenim v spremnih dokumentih, se na spremnih dokumentih (tovorni list, račun, tovorni list, register dokumentov o kakovosti in drugi dokumenti, ki potrjujejo količino ali kakovost) pritrdi prevzemni žig. prejetega blaga), ki potrjuje dejstvo, da so sprejeti farmacevtski izdelki v skladu s podatki, navedenimi v spremnih dokumentih. Finančno odgovorna oseba, ki prevzema farmacevtsko blago, se podpiše na spremne listine in jih overi s pečatom subjekta trgovine na drobno (če obstaja).
47. V primeru neskladja med farmacevtskim blagom, dobavljenim trgovskemu subjektu, in pogoji pogodbe, spremnimi dokumenti, komisija maloprodajnega subjekta v skladu s sprejetim standardnim operativnim postopkom sestavi akt. , ki je podlaga za vložitev reklamacije pri dobavitelju (sestava akta enostransko s strani materialno odgovorne osebe je možna v primeru soglasja dobavitelja ali odsotnosti njegovega predstavnika).
Subjekt trgovine na drobno lahko v dogovoru z dobaviteljem odobri drugačen način obveščanja dobavitelja o neskladnosti dobavljenih farmacevtskih izdelkov s spremnimi dokumenti.
48. Zdravila so ne glede na vir dobave predmet prevzemne kontrole, da se prepreči vstop ponarejenih, podstandardnih in ponarejenih zdravil na trg.
Sprejemna kontrola je sestavljena iz preverjanja prejetih zdravil z ocenjevanjem:
a) videz, barva, vonj;
b) celovitost embalaže;
c) skladnost označevanja zdravil z zahtevami, ki jih določa zakonodaja o prometu z zdravili;
d) pravilna izvedba spremnih dokumentov;
e) prisotnost registra izjav, ki potrjujejo kakovost zdravil v skladu z veljavnimi regulativnimi dokumenti.
49. Za izvajanje nadzora sprejema se z odredbo vodje maloprodajnega subjekta ustanovi komisija za sprejem. Člani komisije morajo biti seznanjeni z vsemi zakonodajnimi in drugimi regulativnimi pravnimi akti Ruske federacije, ki določajo osnovne zahteve za farmacevtske izdelke, izvedbo spremnih dokumentov in njihovo popolnost.
50. Pred dobavo v prodajni prostor je treba farmacevtske izdelke opraviti predprodajno pripravo, ki vključuje razpakiranje, sortiranje in pregled, preverjanje kakovosti izdelka (z zunanjimi znaki) in razpoložljivosti potrebnih informacij o izdelku in njegovem dobavitelj.
51. Medicinski, otroški in dietetični izdelki, biološko aktivni aditivi so živilski izdelki, ki jih je treba pred dobavo v trgovski prostor ali drug kraj trgovanja osvoboditi posod, ovojnih in vezivnih materialov ter kovinskih sponk. Subjekt trgovine na drobno mora tudi na podlagi zunanjih znakov preverjati kakovost medicinskih, otroških in dietetičnih izdelkov, prehranskih dopolnil, preverjati razpoložljivost potrebne dokumentacije in informacij ter izvajati zavrnitev in sortiranje.
Trgovina z medicinskimi, otroškimi in dietetskimi izdelki, biološko aktivnimi dodatki je prepovedana, če je kršena celovitost embalaže. Kakovost te skupine blaga potrjuje potrdilo o državni registraciji, ki navaja obseg uporabe in uporabe, ter dokument proizvajalca in (ali) dobavitelja, ki potrjuje varnost izdelka - izjavo o skladnosti kakovosti ali register izjav.
V primeru kršitve celovitosti embalaže ali pomanjkanja celotnega paketa dokumentov je treba medicinske, otroške in dietne izdelke, prehranska dopolnila vrniti dobavitelju.
52. Razkužila morajo pred dobavo v prodajni prostor ali na prodajnem mestu opraviti predprodajno pripravo, ki vključuje odstranitev iz transportnih posod, sortiranje, preverjanje celovitosti embalaže (vključno z delovanjem aerosolne embalaže) in kakovost izdelka po zunanjih znakih, razpoložljivost potrebnih informacij o razkužilih in njihovem proizvajalcu, navodila za uporabo.
Parfumski in kozmetični izdelki, dobavljeni v trgovinsko cono, morajo izpolnjevati zahteve, določene s Sklepom Komisije carinske unije z dne 23. septembra 2011 N 799 „O sprejetju tehničnih predpisov carinske unije „O varnosti parfumov in kozmetike“. izdelki«.
VII. Prodaja farmacevtskih izdelkov
53. Trgovina na drobno s farmacevtskimi izdelki obsega prodajo, izdajo in farmacevtsko svetovanje.
Za opravljanje farmacevtsko svetovalnih storitev je dovoljeno dodeliti poseben prostor, tudi za čakanje potrošnikov, z namestitvijo ali določitvijo posebnih omejevalnikov in organizacijo sedežev.
54. Farmacevtski delavec pri prodaji zdravil nima pravice kupcu prikrivati podatkov o razpoložljivosti drugih zdravil z enakim mednarodnim nelastniškim imenom in njihovih cenah glede na zahtevano.
55. V nakupovalnem območju se na priročnem mestu za ogled nahajajo:
a) kopijo dovoljenja za opravljanje lekarniške dejavnosti;
b) kopijo dovoljenja za promet s prepovedanimi drogami, psihotropnimi snovmi in njihovimi predhodnimi sestavinami, gojenje prepovedanih rastlin (če je na voljo);
c) informacije o nemožnosti vračila in zamenjave farmacevtskega blaga ustrezne kakovosti;
d) druge dokumente in informacije, s katerimi je treba seznaniti kupce.
56. Na zahtevo kupca ga mora farmacevtski delavec seznaniti s priloženo dokumentacijo za izdelek, ki za vsako ime izdelka vsebuje informacije o obvezni potrditvi skladnosti v skladu z zakonodajo Ruske federacije o tehničnih predpisih (certifikat o skladnosti, njegov številko, obdobje veljavnosti, organ, ki je potrdilo izdal, ali podatke o izjavi o skladnosti, vključno z njeno registrsko številko, obdobjem veljavnosti, imenom osebe, ki je sprejela izjavo, in organom, ki jo je registriral). Ti dokumenti morajo biti overjeni s podpisom in žigom (če obstaja) dobavitelja ali prodajalca z navedbo naslova njegove lokacije in kontaktne telefonske številke.
57. Promet na drobno s farmacevtskim blagom, ki ni v zvezi z zdravili, lahko opravljajo delavci, ki nimajo farmacevtske izobrazbe ali dodatne strokovne izobrazbe iz trgovine na drobno z zdravili, če delajo v ločenih službah (ambulanti, ambulanti in bolničarji). porodnišnice, centri (oddelki) splošne zdravstvene (družinske) prakse), zdravstvene organizacije, ki imajo dovoljenje za opravljanje farmacevtske dejavnosti in se nahajajo na podeželju, kjer ni lekarn.
58. Vsak subjekt trgovine na drobno mora imeti knjigo ocen in predlogov, ki jo kupec izroči na njegovo zahtevo.
VIII. Izvajanje ocen uspešnosti
59. Vodja maloprodajnega subjekta opravi oceno dejavnosti, da preveri popolnost izpolnjevanja zahtev, določenih s tem pravilnikom, in določi korektivne ukrepe.
60. Vprašanja v zvezi s kadri, prostori, opremo, dokumentacijo, spoštovanjem pravil trgovanja s farmacevtskimi izdelki, ukrepi za delo z ocenami in predlogi kupcev, delo za odkrivanje ponarejenih, podstandardnih, ponarejenih farmacevtskih izdelkov ter aktivnosti za vodenje notranjih revizije mora analizirati vodja maloprodajnega subjekta v skladu z odobrenim urnikom.
61. Notranjo revizijo morajo neodvisno in skrbno izvajati osebe, ki jih posebej imenuje vodja maloprodajnega subjekta in so zaposlene v maloprodajnem subjektu in (ali) pogodbeno angažirane.
Po odločitvi vodje maloprodajnega subjekta se lahko izvede neodvisna revizija, vključno s strokovnjaki tretjih maloprodajnih subjektov.
62. Rezultati notranje revizije so dokumentirani.
Dokumenti, sestavljeni kot rezultat revizije, morajo vsebovati vse pridobljene podatke in predloge potrebnih korektivnih ukrepov.
Izvedeni ukrepi na podlagi rezultatov notranje revizije so tudi dokumentirani.
63. Notranja revizija se izvaja tudi z namenom odkrivanja pomanjkljivosti v skladu z zahtevami zakonodaje Ruske federacije in dajanja priporočil za korektivne in preventivne ukrepe.
64. Program notranje revizije bi moral upoštevati rezultate prejšnjih notranjih revizij in inšpekcijskih pregledov regulativnih organov.
65. Odgovorna oseba za področje dejavnosti subjekta trgovine na drobno, ki se pregleduje, mora zagotoviti takojšnje korektivne in preventivne ukrepe.
Nadaljnji ukrepi morajo vključevati revizijo izvedenih korektivnih in preventivnih ukrepov ter poročilo o rezultatih sprejetih ukrepov in njihovi učinkovitosti.
66. Vodja subjekta trgovine na drobno mora zagotoviti identifikacijo farmacevtskih izdelkov, ki ne izpolnjujejo zahtev regulativne dokumentacije, da se prepreči njihova nenamerna uporaba ali prodaja.
Ponarejene, podstandardne, ponarejene farmacevtske izdelke je treba identificirati in izolirati od drugih farmacevtskih izdelkov v skladu s standardnimi operativnimi postopki.
Označevanje, lokacija in metode razmejitve karantenskega območja ter oseba, odgovorna za delo z navedenimi farmacevtskimi izdelki, so določeni z odredbo vodje maloprodajnega subjekta.
67. Vodja maloprodajnega subjekta mora nenehno izboljševati učinkovitost sistema kakovosti, med drugim z uporabo rezultatov notranje presoje, analize podatkov, korektivnih in preventivnih ukrepov.
68. Standardni operativni postopki morajo opisovati, kako:
a) analiziranje pritožb in predlogov strank ter sprejemanje odločitev o njih;
b) ugotavljanje razlogov za kršitev zahtev tega pravilnika in drugih zahtev regulativnih pravnih aktov, ki urejajo promet farmacevtskih izdelkov;
c) presojo potrebe in smotrnosti sprejetja ustreznih ukrepov za preprečitev ponovne podobne kršitve;
d) prepoznavanje in izvajanje potrebnih ukrepov za preprečitev, da bi ponarejeni, podstandardni in ponarejeni farmacevtski izdelki prišli do kupca;
e) analiziranje učinkovitosti sprejetih preventivnih in korektivnih ukrepov.
Najnovejša gradiva spletnega mesta
hrana

Trgovske zarote, ki jih je treba brati vsak dan
V ljudski domišljiji je uporaba magije povezana predvsem z ljubeznijo, sovraštvom in drugimi strastmi. Vendar pa se v resnici magija pogosto uporablja ne le za očaranje nekoga ali maščevanje nekomu, ampak tudi za reševanje precej praktičnih problemov.
Revija

Kaj je offshore podjetje in kako ga prepoznati?
Skoraj vsi smo slišali za obstoj takega, kot so offshore podjetja, vendar vsi ne razumejo pomena tega izraza. Kaj so offshore podjetja v ekonomskem smislu? To so finančni centri, ki z zagotavljanjem privabljajo tuji kapital
Varstvo in zabava
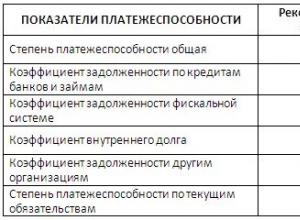
Finančna analiza primera podjetja
Pri pripravi poslovnega načrta je treba analizirati kazalnike finančnega stanja organizacije, ki izvaja naložbeni projekt. Če projekt vključuje ustanovitev nove organizacije, potem je ta stopnja v začetni fazi zamujena in
Rekreacija in zabava
Delovni čas in razpored: vsa načela pravilne organizacije delovnih rutin
Razpored delovnega časa za leto 2019 je večkomponentni dokument, ki obvešča o: normiranem delovnem času; število vikendov in delovnih dni; meje in trajanje delovnega dne; kombinacija delovnih obdobij z obdobji počitka
Varstvo in zabava

Možnosti in postopek odpuščanja med bolniško odsotnostjo
V času bolniške odsotnosti lahko daš odpoved samo na lastno pobudo. Če do odpovedi na bolniškem dopustu pride po odločitvi delodajalca (na podlagi odsotnosti zaradi bolezni, odpovedi zaradi zmanjšanja števila zaposlenih itd.), so njegova dejanja nezakonita.
Ideje za dom

Disciplinske sankcije: zapovedi za kadrovske delavce. Rešiti vprašanje disciplinske odgovornosti
Privedba delavca do disciplinske odgovornosti: shema Postopek za privedbo delavcev do disciplinske odgovornosti ureja čl. 193 delovnega zakonika Ruske federacije (v nadaljnjem besedilu delovni zakonik Ruske federacije). Podrobnosti so razkrite na naši spletni strani v člankih: Od katere starosti
