Ce sunt politicile, standardele și procedurile. Introducerea regulilor de bună practică în farmacie, practică de depozitare și transport a medicamentelor de uz medical Cu privire la aprobarea regulilor de bună practică în farmacie a medicamentelor de uz medical.
2. Sfera spirituală a societăţii. Probleme de dezvoltare a culturii spirituale în Rusia modernă.
Cuvântul „politică” provine din cuvântul grecesc politike, care înseamnă „afaceri de stat”, „arta guvernării” atunci când este tradus în rusă.
Politica nu a existat întotdeauna. Printre motivele apariției sale se numără polarizarea societății, apariția contradicțiilor sociale și a conflictelor care necesită rezolvare, precum și nivelul crescut de complexitate și importanță a conducerii societății, care a necesitat formarea unor autorități speciale separate de popor. Apariţia puterii politice şi de stat este
cea mai importantă condiție prealabilă pentru politică.
Știința oferă diverse definiții ale conceptului de „politică”:
1. Politica sunt relațiile dintre state, clase, grupuri sociale, națiuni care se nasc cu privire la acapararea, exercitarea și păstrarea puterii politice în societate, precum și relațiile dintre state pe arena internațională.
2. Politica este activitatea organelor guvernamentale, partidelor politice, asociațiilor obștești în sfera relațiilor dintre grupurile sociale (clase, națiuni, state), care vizează integrarea eforturilor acestora în scopul întăririi sau dobândirii puterii politice.
3. Politica este sfera de activitate a grupurilor, partidelor, indivizilor, statului, asociată cu realizarea unor interese general semnificative cu ajutorul puterii politice.
Funcțiile politicii sunt înțelese ca un set de procese care își exprimă scopul în societate. Printre funcţiile politicii se numără: a) exprimarea unor interese semnificative ale tuturor grupurilor şi sectoarelor societăţii; b) integrarea diverselor pături sociale, menţinerea integrităţii societăţii; c) asigurarea dezvoltării ulterioare a societăţii; d) managementul si conducerea proceselor sociale, rezolvarea conflictelor si contradictiilor; e) socializarea politică a individului (adică procesul de asimilare de către un individ a cunoștințelor socio-politice, normelor, valorilor și aptitudinilor de activitate).
putere, în urma căreia își asumă un anumit rol politic).
În funcție de amploarea implementării, se disting politicile locale, regionale, naționale și internaționale și în funcție de momentul implementării - curent, pe termen lung și pe termen lung.
Subiecții politicii sunt indivizii, grupurile sociale, straturile, organizațiile implicate direct sau indirect în procesul de exercitare a puterii politice sau de influențare a acesteia. Subiecții politicii pot fi: a) comunități sociale (clase, națiuni etc.);
b) diverse organizaţii şi asociaţii (state, partide, mişcări, biserici etc.); c) elite politice (grupuri privilegiate care ocupă funcții de conducere în structurile guvernamentale, direct implicate în luarea deciziilor guvernamentale); d) indivizi (inclusiv lideri politici). Gradul și limitele activității politice ale subiecților politici depind de sistemul politic existent în țară, care determină limitele și normele activității politice; asupra structurii sociale a societății, prezența sau absența barierelor sociale (calificări, restricții de castă, naționale, religioase, de clasă și alte restricții);
asupra statutului social al unui anumit strat, personalitate, instituție socială; din factori subiectivi (calitățile personale ale unei persoane, numărul și sistemul de valori al mișcărilor și partidelor politice etc.) și alții
circumstanțe (de exemplu, situația politică din țară).
Obiectele politicii (adică relațiile sociale, domeniile vieții publice către care se îndreaptă politica) sunt diverse. Politica internă reglementează relațiile care decurg din exercitarea puterii politice în cadrul societății, iar politica externă reglementează relațiile dintre state pe arena internațională. La rândul lor, în funcţie de obiectele către care se îndreaptă politica internă, se disting politici economice, sociale, culturale, militare, de mediu etc.
Biletul numărul 15
Potrivit art. 55 din Legea federală nr. 61-FZ „Cu privire la circulația medicamentelor”, comerțul cu amănuntul cu medicamente se desfășoară în conformitate cu regulile de bună practică în farmacie (în continuare - GAP), aprobate de organul executiv federal autorizat.
Să aruncăm o privire mai atentă la regulile NAP cu privire la următoarele puncte:
1.
Ce documentație de reglementare aprobă regulile PNA?
La 1 martie 2017, a intrat în vigoare Ordinul Ministerului Sănătății al Federației Ruse din 31 august 2017 nr. 647n „Cu privire la aprobarea Regulilor de bună practică farmaceutică a medicamentelor de uz medical”.
2.
Ce cerințe stabilesc regulile PNA?
Aceste reguli stabilesc cerințe pentru implementarea comerțului cu amănuntul de către organizațiile de farmacie, întreprinzătorii individuali (IP) cu licență pentru activități farmaceutice, organizațiile medicale cu licență pentru activități farmaceutice și diviziile lor separate (clinici ambulatoriu, paramedic și paramedic-obstetricale, stații, centre (secții) cabinet medical general (de familie), situate în localități rurale în care nu există organizații de farmacie, organizații de farmacie și organizații medicale sau diviziile lor separate, dacă organizațiile de farmacie, organizațiile medicale, secțiile lor separate au licența prevăzută de legislația Federației Ruse privind acordarea de licențe pentru tipuri individuale de activități care distribuie droguri narcotice și psihotrope persoanelor fizice.
3.
Care sunt cerințele regulilor PNA?
Aceste Reguli au drept scop furnizarea populației cu medicamente, produse medicale de înaltă calitate, eficiente și sigure, precum și dezinfectanți, articole și produse de igienă personală, ustensile de uz medical, articole și mijloace destinate îngrijirii bolnavilor, nou-născuților și copii sub trei ani, optica ochelarilor și produse de îngrijire, ape minerale, produse alimentare medicale, pentru bebeluși și dietetice, suplimente alimentare, parfumuri și produse cosmetice, publicații tipărite medicale și educaționale pentru sănătate destinate promovării unui stil de viață sănătos.
4.
Ce răspundere este prevăzută pentru încălcarea regulilor PNA?
În conformitate cu articolul 5 din Legea federală nr. 61-FZ „Cu privire la circulația medicamentelor”, competențele autorităților executive federale (în acest caz vorbim despre Serviciul Federal de Supraveghere în Sănătate (Roszdravnadzor) și organele sale teritoriale) în circulația medicamentelor includ organizarea și (sau) efectuarea de inspecții la subiecții circulației medicamentelor pentru respectarea regulilor de bună practică în farmacie.
Încălcarea cerințelor regulilor NAP este o infracțiune administrativă, a cărei răspundere este prevăzută în partea 1 a art. 14.4.2 din Codul de infracțiuni administrative al Federației Ruse și implică impunerea unei amenzi administrative: pentru un funcționar - de la cinci mii la zece mii de ruble, pentru o persoană juridică - de la douăzeci de mii la treizeci de mii de ruble.
În general, regulile PNA pot fi împărțite în cinci domenii principale, care vor fi discutate în continuare:
I. Funcționari ai unei organizații de farmacie (care sunt cerințele pentru conducătorul entității și personalul în conformitate cu cerințele PNA);
II. Documentație obligatorie (comenzi interne ale organizației de farmacie, licență etc.);
III. Cerințe pentru infrastructura organizației;
IV. Procese de operare cheie (POS);
V. Audit intern (optimizarea activității organizației și pregătirea pentru eventuale inspecții de către autoritățile de reglementare).
eu. Cerințe pentru funcționarii unei organizații de farmacie.
Pentru a asigura o aprovizionare neîntreruptă cu produse farmaceutice către clienți, șeful unei entități de comerț cu amănuntul organizează:
a) asigurarea unui sistem de achiziții care împiedică distribuirea de produse farmaceutice falsificate, substandard, contrafăcute;
b) dotarea sediului cu echipamente care să asigure manipularea corespunzătoare a produselor farmaceutice, inclusiv depozitarea, contabilitatea, vânzarea și eliberarea acestora;
c) accesul la informații cu privire la procedura de aplicare sau de utilizare a produselor farmaceutice, inclusiv regulile de eliberare, metodele de administrare, regimurile de dozare, efectele terapeutice, contraindicațiile, interacțiunile medicamentelor atunci când sunt luate concomitent între ele și (sau) cu alimente, regulile pentru acestea. depozitare la domiciliu (denumită în continuare consultanță farmaceutică);
d) informarea clienților cu privire la disponibilitatea mărfurilor, inclusiv a medicamentelor din segmentul de preț mai mic.
Șeful unei entități de comerț cu amănuntul asigură, de asemenea:
a) reducerea pierderilor de producție, optimizarea activităților, creșterea cifrei de afaceri comerciale, creșterea nivelului de cunoștințe și calificare a lucrătorilor din domeniul farmaceutic;
b) resursele necesare pentru funcționarea tuturor proceselor entității de comerț cu amănuntul pentru a respecta cerințele de licențiere, cerințele sanitare și epidemiologice, normele de sănătate și securitate în muncă, reglementările împotriva incendiilor și alte cerințe stabilite de legislația Federației Ruse;
c) disponibilitatea unor sisteme informatice care să permită operațiuni legate de distribuirea mărfurilor și identificarea medicamentelor falsificate, contrafăcute și substandard.
Șeful unei entități de comerț cu amănuntul asigură și menține în stare de funcționare infrastructura necesară îndeplinirii cerințelor de licențiere pentru implementarea activităților farmaceutice, care include:
Șeful unei entități de comerț cu amănuntul se asigură, de asemenea, că angajații sunt informați despre:
a) regulile actuale ale PNA și respectarea acestora;
b) drepturi și obligații determinate de fișele postului și standardele profesionale;
c) informații privind modificările aduse legislației Federației Ruse care reglementează raporturile juridice apărute în timpul circulației produselor farmaceutice, inclusiv modificările regulilor de eliberare a medicamentelor;
d) informații privind rezultatele auditurilor interne și externe;
e) informații privind acțiunile preventive și corective necesare pentru eliminarea (prevenirea) încălcărilor cerințelor de licențiere;
f) informații cu privire la rezultatele luării în considerare a reclamațiilor și sugestiilor din partea clienților.
Șeful unei entități de comerț cu amănuntul analizează sistemul calității în conformitate cu graficul aprobat de acesta.
Analiza include o evaluare a posibilității de îmbunătățiri și a necesității de schimbări în organizarea sistemului calității, inclusiv în politicile și obiectivele activităților, și se realizează prin luarea în considerare a rezultatelor auditurilor interne (inspecții), a unei cărți de recenzii și sugestii, chestionare, dorințe orale ale clienților (feedback de la cumpărător), realizări moderne ale științei și tehnologiei, articole, recenzii și alte date
Pe baza rezultatelor analizei sistemului calității, șeful unei entități de comerț cu amănuntul poate decide cu privire la necesitatea și (sau) oportunitatea creșterii eficacității sistemului calității și a proceselor acestuia, îmbunătățirea calității serviciilor farmaceutice, schimbări în nevoia de resurse (materiale, financiare, de muncă și altele), investițiile necesare pentru îmbunătățirea serviciului clienți, sisteme de motivare a angajaților, instruire suplimentară (instruire) pentru angajați și alte soluții.
De asemenea, șeful unei entități de comerț cu amănuntul asigură o analiză a conformității cu politicile și obiectivele de afaceri, rapoarte de audit intern și inspecții externe în vederea îmbunătățirii serviciilor farmaceutice furnizate.
Întrebări referitoare la:
- personal,
- sediul,
- echipamente,
- documentație,
- respectarea regulilor comerciale cu produse farmaceutice,
- activități de lucru cu recenzii și sugestii ale clienților,
- lucrează la identificarea produselor farmaceutice contrafăcute, substandard, contrafăcute, precum și
- activitatile de audit intern trebuie analizate de catre conducatorul entitatii de comert cu amanuntul in conformitate cu graficul aprobat.
Regulile PNA prevăd că, pentru a respecta cerințele stabilite, o entitate de comerț cu amănuntul, ținând cont de volumul de servicii farmaceutice pe care le prestează, trebuie să aibă personalul necesar.
Cerințele pentru calificările și experiența de muncă a șefului unei entități de comerț cu amănuntul și a lucrătorilor săi farmaceutici sunt stabilite de Regulamentul privind licențierea activităților farmaceutice (în prezent - Decretul Guvernului Federației Ruse din 22 decembrie 2011 N 1081 „Cu privire la licențiere a activităților farmaceutice”).
De asemenea, în regulile PNA apare o nouă clauză (clauza 57), potrivit căreia comerțul cu amănuntul cu produse farmaceutice care nu au legătură cu medicamente poate fi efectuat de către angajați care nu au studii farmaceutice sau studii profesionale suplimentare în comerțul cu amănuntul. de medicamente dacă lucrează în secții separate (ambulatori, centre paramedic și paramedic-obstetricale, centre (departamente) de medicină generală (de familie)) ale organizațiilor medicale autorizate să desfășoare activități farmaceutice și situate în mediul rural unde nu există farmacie. organizatii.
De remarcat că în acest caz vorbim în mod specific despre produse farmaceutice care nu au legătură cu medicamentele. Vânzarea de medicamente de către angajații care nu au studii farmaceutice sau studii profesionale suplimentare în comerțul cu amănuntul al medicamentelor va fi considerată abatere și va atrage răspunderea administrativă!
În ceea ce privește cerințele directe pentru personalul unei organizații de farmacie, fiecare angajat trebuie să fie familiarizat cu drepturile și responsabilitățile sale cuprinse în fișele postului și standardele profesionale.
De asemenea, un angajat care efectuează lucrări care afectează calitatea produsului trebuie să aibă calificările și experiența de muncă necesare pentru a respecta cerințele stabilite de regulile PNA.
Regulile PNA prevăd, de asemenea, principalele funcții ale lucrătorilor din domeniul farmaceutic:
a) vânzarea de produse farmaceutice de calitate corespunzătoare;
b) furnizarea de informații fiabile despre produsele farmaceutice, costurile acestora, consultanță farmaceutică;
c) informații despre utilizarea rațională a medicamentelor în scopul automedicației responsabile;
d) producerea de medicamente conform prescripțiilor și cerințelor de facturare ale organizațiilor medicale;
e) intocmirea documentatiei contabile;
f) respectarea eticii profesionale.
II. Documentatie obligatorie.
Toată documentația obligatorie a unei organizații de farmacie poate fi împărțită în 9 blocuri principale:
- documentatie privind personalul farmaciei;
- licenta de desfasurare a activitatilor farmaceutice;
- documente care confirmă calitatea produselor farmaceutice;
- rapoarte de inspectie;
- registre;
- jurnale care trebuie menținute în conformitate cu regulile PNA;
- documentatia echipamentului;
- POS (documente privind procedurile standard de operare);
- comenzi interne.
Documentatie privind personalul farmaciei.
Documentația sistemului calității este păstrată de către angajații autorizați de șeful entității de comerț cu amănuntul pe suport hârtie și (sau) electronic și include, printre altele, carduri personale ale angajaților entității de comerț cu amănuntul;
a) structura organizatorica;
b) regulamentul intern al muncii;
c) fișe de post cu o notă privind familiarizarea angajaților care dețin funcțiile relevante;
d) personalul.
Pentru angajații nou angajați, în conformitate cu reglementările locale ale entității de comerț cu amănuntul, se implementează un program de adaptare și se verifică periodic calificările, cunoștințele și experiența acestor angajați.
Programul de adaptare include, printre altele:
a) formare de inițiere la angajare;
b) instruire (instruire) la locul de muncă (inițială și repetată);
c) actualizarea cunoștințelor:
- legislația Federației Ruse în domeniul circulației medicamentelor și al protecției sănătății publice, al protecției drepturilor consumatorilor;
- reguli de igienă personală;
- privind procedura de prestare a serviciilor farmaceutice, inclusiv consultanta farmaceutica si utilizarea produselor medicale la domiciliu;
- dezvoltarea abilităților de comunicare și prevenirea conflictelor;
- instructiuni privind siguranta si protectia muncii.
Șeful unei entități de comerț cu amănuntul se asigură că pregătirea (instruirea) inițială și ulterioară a angajaților cu privire la următoarele aspecte se desfășoară conform programului aprobat de acesta:
a) reguli de eliberare a medicamentelor de uz medical;
b) reguli de eliberare a stupefiantelor și a substanțelor psihotrope (NS și PS), înregistrate ca medicamente, medicamente care conțin NS și PS;
c) reguli de eliberare a medicamentelor supuse contabilității subiect-cantitative (SQR), reguli de ținere a unui jurnal al medicamentelor supuse SQR;
d) reguli de eliberare a medicamentelor care conțin cantități mici de stupefiante (NS);
e) procedura de pastrare a retetelor;
f) respectarea cerințelor de disponibilitate a unui sortiment minim;
g) respectarea cerințelor de bună practică pentru depozitarea și transportul medicamentelor;
h) aplicarea sumelor maxime stabilite de majorări cu amănuntul la prețurile efective de vânzare ale producătorilor pentru medicamentele incluse în lista medicamentelor vitale și esențiale, procedura de stabilire a prețurilor la astfel de medicamente;
i) respectarea cerințelor pentru lucrul cu produse farmaceutice falsificate, de calitate scăzută, contrafăcute;
j) respectarea restricțiilor impuse lucrătorilor din domeniul farmaceutic atunci când își desfășoară activitățile profesionale;
k) îmbunătățirea cunoștințelor despre medicamente, inclusiv medicamentele generice și interschimbabile, capacitatea de a oferi informații comparative despre medicamente și prețuri, inclusiv medicamentele din segmentul de preț mai mic, despre medicamente noi, forme de dozare, indicații de utilizare;
l) metode de prelucrare a datelor primite de la cumpărători cu privire la aspecte legate de consumul de medicamente identificate în timpul consumului, efecte secundare, comunicarea acestor informații către părțile interesate;
m) respectarea cerințelor de protecție a muncii.
Astfel, programul de pregătire inițială și ulterioară a angajaților trebuie să includă în mod necesar toate punctele de mai sus.
Licenta de desfasurare a activitatilor farmaceutice.
Documentația sistemului calității este păstrată de către angajații autorizați de șeful entității de comerț cu amănuntul pe suport hârtie și (sau) electronic și include, printre altele, licență pentru dreptul de a desfășura activități farmaceutice și anexe la aceasta.
Documente care confirmă calitatea produselor farmaceutice.
Documentația sistemului calității este păstrată de către angajații autorizați de șeful entității de comerț cu amănuntul pe suport hârtie și (sau) electronic și include, printre altele, documente referitoare la suspendarea (reluarea) vânzărilor de produse farmaceutice, retragerea (retragerea) de produse farmaceutice. medicamente din circulatie, identificarea cazurilor de circulatie a produselor medicale neinregistrate.
Vă rugăm să rețineți că întreținerea acestei documentații trebuie să fie organizată de un angajat special autorizat; De asemenea, este necesară monitorizarea informațiilor primite de la autoritățile Roszdravnadzor cu privire la suspendarea (reluarea) vânzării de produse farmaceutice, retragerea (retragerea) medicamentelor din circulație și identificarea cazurilor de circulație a dispozitivelor medicale neînregistrate.
Rapoarte de inspecție.
Documentația sistemului calității este păstrată de către angajații autorizați de șeful entității de comerț cu amănuntul pe suport hârtie și (sau) electronic și include, printre altele, rapoarte de inspecție ale entității de comerț cu amănuntul de către funcționarii organelor de control (supraveghere) de stat, control municipal. organelor si auditurilor interne.
Registrele.
Documentele privind planificarea eficientă a activităților, implementarea proceselor de asigurare a sistemului calității și managementul acestora, în funcție de funcțiile îndeplinite de entitatea de comerț cu amănuntul, includ un registru al prețurilor înregistrate pentru medicamentele incluse în lista medicamentelor vitale și esențiale.
Aceste informații (prețurile maxime de vânzare cu amănuntul pentru medicamentele vitale și esențiale), conform Legii federale nr. 61-FZ „Cu privire la circulația medicamentelor”, trebuie comunicate vizitatorilor organizației de farmacie.
Jurnalele care trebuie menținute în conformitate cu regulile PNA.
Documentele privind planificarea eficientă a activităților, implementarea proceselor de asigurare a sistemului calității și managementul acestora, în funcție de funcțiile îndeplinite de entitatea de comerț cu amănuntul, includ:
e) jurnalul briefing-ului introductiv privind protecția muncii;
f) un jurnal de înregistrare a instrucțiunilor la locul de muncă;
g) jurnalul ședințelor de securitate la incendiu;
h) jurnalul de bord pentru briefing-uri privind siguranța electrică;
i) un jurnal de comenzi (instrucțiuni) pentru o entitate de comerț cu amănuntul;
j) un jurnal de înregistrare zilnică a parametrilor de temperatură și umiditate în spațiile de depozitare a medicamentelor, dispozitivelor medicale (DM) și suplimentelor alimentare;
k) un jurnal de înregistrare periodică a temperaturii din interiorul echipamentului frigorific;
l) un jurnal al tranzacțiilor legate de circulația medicamentelor incluse în lista medicamentelor supuse PCU (dacă aceste medicamente sunt disponibile) - forma jurnalului este aprobată prin Ordinul Ministerului Sănătății al Federației Ruse din 17 iunie , 2013 N 378n „Cu privire la aprobarea regulilor de înregistrare a tranzacțiilor aferente circulației medicamentelor de uz medical, incluse în lista medicamentelor de uz medical, supuse contabilității subiect-cantitative, în reviste speciale a tranzacțiilor aferente circulației. a medicamentelor de uz medical, precum și regulile de păstrare și păstrare a jurnalelor speciale de tranzacții legate de circulația medicamentelor de uz medical”;
m) un jurnal de inspecții ale unei persoane juridice, întreprinzător individual, efectuate de organele de control (supraveghere) de stat, organismele de control municipale (dacă există) - forma jurnalului este aprobată prin Legea federală din 26 decembrie 2008 N 294 -FZ „Cu privire la protecția drepturilor persoanelor juridice și ale antreprenorilor individuali în implementarea controlului (supravegherii) de stat și controlului municipal”;
o) un jurnal pentru furnizarea de medicamente incluse în gama minimă de medicamente necesare acordării asistenței medicale, dar care nu sunt disponibile la momentul solicitării cumpărătorului;
o) un jurnal de prescripții scrise greșit;
p) un jurnal de bord pentru medicamentele cu termen de valabilitate limitat;
c) jurnalul defectelor;
r) jurnal de ambalaje de laborator;
s) un jurnal al tranzacțiilor legate de circulația stupefiantelor, substanțelor psihotrope și precursorii acestora (dacă aceste medicamente sunt disponibile) - forma jurnalelor este aprobată prin Decretul Guvernului Federației Ruse din 9 iunie 2010 N 419 „Cu privire la furnizarea de informații cu privire la activitățile legate de circulația drogurilor precursoare de droguri și a substanțelor psihotrope și înregistrarea tranzacțiilor legate de traficul acestora” și Decretul Guvernului Federației Ruse din 4 noiembrie 2006 N 644 „Cu privire la procedura pentru transmiterea de informații privind activitățile legate de traficul de stupefiante și substanțe psihotrope, precum și înregistrarea tranzacțiilor legate de traficul de stupefiante și substanțe psihotrope”;
t) jurnal de bord pentru înregistrarea rezultatelor controlului de recepție;
x) un jurnal de primire și consum de vaccinuri (dacă aceste medicamente sunt disponibile);
v) un jurnal al rețetelor care au fost (sunt) în deservire amânată (dacă sunt disponibile medicamente subvenționate);
h) un jurnal de lucru de informare cu organizațiile medicale privind procedura de furnizare gratuită a unor categorii de cetățeni cu medicamente și dispozitive medicale (MD), precum și vânzarea medicamentelor și MI cu reducere.
Documentatia echipamentelor.
Echipamentul utilizat de o entitate comercială cu amănuntul și legat de instrumentele de măsurare este supus verificării și (sau) calibrării inițiale înainte de punere în funcțiune, precum și după reparații și (sau) întreținere, iar în timpul funcționării este supus verificării și (sau) calibrării periodice în în conformitate cu cerințele legislației Federației Ruse pentru a asigura uniformitatea măsurătorilor.
În consecință, documentele care confirmă verificarea echipamentului specificat trebuie să fie disponibile (în cazul unui audit al unei organizații de farmacie de către o autoritate de reglementare).
POS (documente standard de procedură de operare).
Documentația sistemului calității include, printre altele, documente care descriu procedura de furnizare a serviciilor farmaceutice de către o entitate de comerț cu amănuntul (denumite în continuare proceduri standard de operare - POS).
Trebuie remarcat faptul că procedurile standard de operare includ o procedură specifică pentru angajați și responsabilitățile acestora pentru o anumită procedură (responsabil pentru consumul de droguri, procedura sa, responsabil pentru pregătirea înainte de vânzare, acțiunile sale etc.)
Șeful entității de comerț cu amănuntul asigură aprobarea procedurilor standard de operare (acesta este o comandă internă, care va fi discutată mai jos).
Toate procesele unei entități de comerț cu amănuntul care afectează calitatea, eficiența și siguranța produselor farmaceutice sunt efectuate în conformitate cu procedurile standard de operare aprobate ( aproximativ în secțiunea „Procesele de activitate ale unei entități de comerț cu amănuntul produse farmaceutice” se referă la procesele de achiziție, acceptare și pregătire înainte de vânzare).
Pentru a rezuma, POS într-o organizație de farmacie ar trebui dezvoltate pentru următoarele procese:
- achiziționarea de produse farmaceutice;
- acceptarea acestora;
- depozitare;
- pregatire inainte de vanzare;
- vanzari de produse farmaceutice;
- control de calitate.
În cazul unei neconcordanțe între produsele farmaceutice furnizate unei entități de comerț cu amănuntul și termenii contractului și documentele însoțitoare, comisia entității de comerț cu amănuntul, în conformitate cu procedura standard de operare aprobată, întocmește un act prin care stă la baza depunerii pretenţiilor către furnizor (întocmirea actului unilateral de către persoana responsabilă financiar este posibilă cu acordul furnizorului sau absenţa reprezentantului acestuia).
Astfel, ar trebui elaborate și POS-uri pentru procedurile de întocmire a unui raport de revendicare către furnizor și de identificare și izolare a produselor farmaceutice falsificate, substandard, contrafăcute.
Procedurile de operare standard ar trebui să descrie cum să:
a) analiza reclamațiilor și sugestiilor clienților și luarea deciziilor cu privire la acestea;
b) stabilirea motivelor de încălcare a cerințelor normelor PNA și a altor cerințe ale actelor juridice de reglementare care reglementează circulația produselor farmaceutice;
c) evaluarea necesității și fezabilității luării măsurilor adecvate pentru a evita reapariția unei încălcări similare;
d) identificarea și implementarea acțiunilor necesare pentru a preveni ca produsele farmaceutice contrafăcute, substandard, contrafăcute să ajungă la cumpărător;
e) analizarea eficacității acțiunilor preventive și corective întreprinse.
Astfel, regulile PNA nu aprobă o formă clar definită de proceduri standard de operare (descrierea acțiunilor în detaliu sau pe scurt, cu sau fără trimiteri la documentația de reglementare).
Fiecare organizație de farmacie are posibilitatea de a-și nota propriile proceduri standard de operare, dar procedurile de mai sus trebuie incluse în POS-urile organizației de farmacie. Dacă este nevoie de noi POS pentru a crește eficiența și a-și optimiza activitățile, organizația de farmacie are tot dreptul să introducă un nou POS prin ordinea sa internă.
Comenzi interne.
Documentația sistemului calității se menține de către angajații autorizați de șeful entității de comerț cu amănuntul pe suport hârtie și (sau) electronic și include, printre altele, comenzi și instrucțiuni de la șeful entității de comerț cu amănuntul privind activitatea principală.
În continuare, vor fi date denumirile aproximative ale acestor comenzi interne (pot fi modificate chiar de organizație, dar fără a pierde sensul principal) și paragraful din regulile PNA care definesc cerințele pentru aceste comenzi.
- „Cu privire la implementarea unui set de măsuri care vizează respectarea cerințelor prezentelor Reguli de bună practică farmaceutică pentru medicamentele de uz medical”
a) determinarea proceselor care afectează calitatea serviciilor prestate de o entitate de comerț cu amănuntul și care vizează satisfacerea cererii clienților pentru produse farmaceutice, obținerea de informații:
- privind regulile de păstrare și utilizare a medicamentelor,
- privind disponibilitatea și prețul medicamentelor, inclusiv primirea de informații prioritare privind disponibilitatea medicamentelor în segmentul de preț mai mic;
b) stabilirea succesiunii și interacțiunii proceselor necesare pentru asigurarea unui sistem de calitate, în funcție de impactul acestora asupra siguranței, eficacității și raționalității utilizării medicamentelor.
c) determinarea criteriilor și metodelor care reflectă obținerea rezultatelor, atât în implementarea proceselor necesare pentru asigurarea sistemului calității, cât și în managementul acestora, ținând cont de cerințele legislației Federației Ruse privind circulația medicamentelor; ;
d) determinarea parametrilor cantitativi și calitativi, inclusiv materiale, financiari, informaționali, de muncă, necesari menținerii proceselor sistemului calității și monitorizării acestora;
e) furnizarea populației cu produse farmaceutice de înaltă calitate, sigure, eficiente;
f) luarea măsurilor necesare pentru atingerea rezultatelor planificate și îmbunătățirea continuă a calității serviciului clienți și creșterea responsabilității personale a angajaților.
- „Despre persoana responsabilă cu implementarea și asigurarea sistemului calității”
- „Pe cei autorizați să întrețină și să păstreze documentația sistemului calității”
clauza 6. Șeful unei entități de comerț cu amănuntul numește persoane responsabile cu menținerea și păstrarea documentelor enumerate mai sus, oferirea accesului la acestea și, dacă este necesar, restaurarea acestora.
- „Despre politica și obiectivele activității”
a) un document privind politica și obiectivele entității de comerț cu amănuntul, care definește modalități de asigurare a cererii clienților pentru produse farmaceutice, minimizarea riscului ca medicamentele, dispozitivele medicale și suplimentele alimentare de calitate scăzută, falsificate și contrafăcute să intre în circulația publică;
clauza 7. Șeful unei entități de comerț cu amănuntul asigură:
b) definirea politicii și a obiectivelor de activitate care vizează ... interacțiunea eficientă între un profesionist medical, un lucrător din domeniul farmaceutic și un cumpărător;
- „La aprobarea manualului calității”
b) un manual al calității care stabilește direcțiile de dezvoltare a unei entități de comerț cu amănuntul, inclusiv pentru o anumită perioadă de timp, și conține referiri la acte legislative și alte acte normative de reglementare care reglementează implementarea activităților farmaceutice;
- „Cu privire la aprobarea procedurilor standard de operare”
c) documente care descriu procedura de furnizare a serviciilor farmaceutice de către o entitate de comerț cu amănuntul (denumite în continuare proceduri standard de operare);
g) aprobarea procedurilor standard de operare;
paragraful 37. Toate procesele unei entități de comerț cu amănuntul care afectează calitatea, eficiența și siguranța produselor farmaceutice sunt efectuate în conformitate cu procedurile standard de operare aprobate.
- „Cu privire la aprobarea măsurilor care vizează stimularea și motivarea activităților angajaților”
f) desfăşurarea de activităţi care vizează stimularea şi motivarea activităţilor angajaţilor;
- „Cu privire la stabilirea unei proceduri interne pentru schimbul de informații”
h) stabilirea unei proceduri interne de schimb de informații, inclusiv de informații legate de funcționarea sistemului calității, inclusiv prin utilizarea unui formular scris (fișă de familiarizare), standuri de anunțuri în locuri publice, desfășurarea de ședințe de informare cu o anumită frecvență, distribuirea electronică a informațiilor la o adresă de e-mail;
- „Cu privire la aprobarea programului de analiză a sistemului calității”
Analiza include o evaluare a posibilității de îmbunătățiri și a necesității de schimbări în organizarea sistemului calității, inclusiv în politicile și obiectivele activităților, și se realizează prin luarea în considerare a rezultatelor auditurilor interne (inspecții), a unei cărți de recenzii și sugestii, chestionare, dorințe orale ale clienților (feedback de la cumpărător), realizări moderne ale științei și tehnologiei, articole, recenzii și alte date.
- „Cu privire la aprobarea formularelor de jurnal”
- „La aprobarea tabelului de personal”
- lista diviziunilor structurale,
- titluri de post,
- specialități,
- profesii care indică calificări,
- informații despre numărul de unități de personal
- și fondul de salarii.
Trebuie remarcat faptul că această ordine internă în lista și numele posturilor trebuie să respecte Ordinul Ministerului Sănătății al Federației Ruse din 20 decembrie 2012 N 1183n „Cu privire la aprobarea Nomenclatorului posturilor de lucrători medicali și de lucrători farmaceutici. ”
- „Cu privire la aprobarea programului de adaptare pentru lucrătorii nou angajați”
Programul de adaptare include, printre altele:
a) formare de inițiere la angajare;
b) instruire (instruire) la locul de muncă (inițială și repetată);
c) actualizarea cunoștințelor:
- legislația Federației Ruse în domeniul circulației medicamentelor și al protecției sănătății publice, al protecției drepturilor consumatorilor;
- reguli de igienă personală;
- privind procedura de prestare a serviciilor farmaceutice, inclusiv consultanta farmaceutica si utilizarea produselor medicale la domiciliu;
d) dezvoltarea abilităților de comunicare și prevenirea conflictelor;
e) instrucţiuni privind securitatea şi protecţia muncii.
- „Cu privire la aprobarea programului de pregătire (instruire) inițială și ulterioară a angajaților”
a) reguli de eliberare a medicamentelor de uz medical;
b) reguli de eliberare a NS și PV înregistrate ca medicamente (MD), medicamente care conțin NS și PV;
c) reguli de eliberare a medicamentelor supuse PKU, reguli de menținere a unui jurnal al medicamentelor supuse PKU;
d) reguli de eliberare a medicamentelor care conțin cantități mici de NS;
e) procedura de pastrare a retetelor;
f) respectarea cerințelor de disponibilitate a unui sortiment minim;
g) respectarea cerințelor de bună practică pentru depozitarea și transportul medicamentelor;
h) aplicarea sumelor maxime stabilite de majorări cu amănuntul la prețurile efective de vânzare ale producătorilor pentru medicamentele incluse în lista medicamentelor vitale și esențiale, procedura de stabilire a prețurilor la astfel de medicamente;
i) respectarea cerințelor pentru lucrul cu produse farmaceutice falsificate, de calitate scăzută, contrafăcute;
j) respectarea restricțiilor impuse lucrătorilor din domeniul farmaceutic atunci când își desfășoară activitățile profesionale;
k) îmbunătățirea cunoștințelor despre medicamente, inclusiv medicamentele generice, medicamentele interschimbabile, capacitatea de a oferi informații comparative despre medicamente și prețuri, inclusiv medicamentele din segmentul de preț mai mic, despre medicamentele noi, formele de dozare ale medicamentelor, indicațiile de utilizare a medicamentelor;
l) metode de prelucrare a datelor primite de la cumpărători cu privire la aspectele legate de consumul de droguri identificate în procesul de aplicare, efecte secundare, comunicarea acestor informații către părțile interesate;
m) respectarea cerințelor de protecție a muncii.
- „Cu privire la aprobarea zonelor și spațiilor utilizate de entitățile comerciale cu amănuntul”
- „Cu privire la accesul la spațiile (zonele) utilizate de entitățile comerciale cu amănuntul”
- „Cu privire la aprobarea procedurii de selectare și evaluare a furnizorilor de produse farmaceutice”
- „Cu privire la persoanele responsabile financiar care acceptă produse farmaceutice”
- „Cu privire la crearea unei comisii de daune”
- „Cu privire la crearea unui comitet de selecție”
„Cu privire la aprobarea programului de analiză a problemelor legate de personal, spații, echipamente, documentație, respectarea regulilor comerțului cu produse farmaceutice, măsuri de lucru cu recenziile și sugestiile clienților, munca pentru identificarea produselor farmaceutice contrafăcute, substandard, contrafăcute; , precum și activități privind efectuarea auditului intern"
clauza 60. Probleme legate de personal, spații, echipamente, documentație, respectarea regulilor comerțului cu produse farmaceutice, măsuri de lucru cu recenziile și sugestiile clienților, munca pentru identificarea produselor farmaceutice contrafăcute, substandard, contrafăcute, precum și activitățile de efectuare a auditurilor interne, ar trebui analizat de către managerul entității de comerț cu amănuntul în conformitate cu graficul aprobat.
- „Cu privire la etichetarea produselor farmaceutice care nu îndeplinesc cerințele documentației de reglementare, locul și metoda de identificare a unei zone de carantină” și
- „Despre persoana responsabilă cu lucrul cu produse farmaceutice care nu îndeplinesc cerințele documentației de reglementare”
III. Cerințe pentru infrastructura organizației.
Cerințele de bază pentru infrastructura unei organizații de farmacie pot fi împărțite în 4 blocuri principale:
- Cerințe generale;
- layout;
-finisare;
- echipamente.
Cerințe generale.
Infrastructura necesară pentru a îndeplini cerințele de licențiere pentru activitățile farmaceutice include, dar nu se limitează la:
a) clădiri, spațiu de lucru și echipamente de lucru asociate;
b) echipamente pentru procese (hardware si software);
c) servicii suport (transport, comunicatii si sisteme informatice).
Spațiile și echipamentele trebuie amplasate, echipate și exploatate în așa fel încât să corespundă funcțiilor îndeplinite (medicamentele personale ale angajaților sau alimentele etc. nu trebuie depozitate în zona de depozitare a medicamentelor)
Aspect.
Amenajarea și proiectarea spațiilor și echipamentelor ar trebui să minimizeze riscul de erori și să permită curățarea și întreținerea eficientă pentru a preveni acumularea de praf sau murdărie și orice factori care ar putea afecta negativ calitatea produselor farmaceutice.
Toate sediile unei entități de comerț cu amănuntul trebuie să fie situate într-o clădire (structură) și
unite funcțional, izolate de alte organizații și asigură absența accesului neautorizat al persoanelor neautorizate în incintă.
Este permisă intrarea (ieșirea) pe teritoriul unei entități de comerț cu amănuntul prin sediul unei alte organizații.
Zona spațiilor utilizate de o entitate de comerț cu amănuntul trebuie împărțită în zone destinate îndeplinirii următoarelor funcții:
a) comerțul cu produse farmaceutice cu asigurarea unor spații de depozitare care nu permit accesul gratuit al cumpărătorilor la bunurile vândute, inclusiv la cele cu rețetă;
b) acceptarea produselor farmaceutice, zona de depozitare de carantină, inclusiv separat pentru medicamente;
c) depozitarea separată a îmbrăcămintei lucrătorilor.
Dacă o entitate de comerț cu amănuntul este situată într-o clădire împreună cu alte organizații, este permisă folosirea în comun a băii.
Spațiile unei entități comerciale cu amănuntul trebuie să fie proiectate și echipate astfel încât să asigure protecție împotriva pătrunderii insectelor, rozătoarelor sau altor animale.
Finisare.
Sediul trebuie să respecte standardele și cerințele sanitare și igienice și să asigure capacitatea de a îndeplini funcțiile de bază ale unei entități de comerț cu amănuntul în conformitate cu cerințele aprobate prin normele PNA.
Sediul unei entități comerciale cu amănuntul trebuie să fie echipat cu sisteme de încălzire și aer condiționat (dacă sunt disponibile), ventilație naturală sau forțată (dacă este disponibil), asigurând condiții de muncă în conformitate cu legislația muncii a Federației Ruse, precum și respectarea cu cerințele bunelor practici pentru depozitarea și transportul medicamentelor.
Sediul unei entități de comerț cu amănuntul poate avea atât iluminat natural, cât și artificial.
Iluminatul artificial general trebuie asigurat în toate încăperile; pentru locurile de muncă individuale, dacă este necesar, se asigură iluminat artificial local.
Materialele utilizate la finisarea și (sau) repararea spațiilor (zonelor) trebuie să respecte cerințele de siguranță la incendiu stabilite de legislația Federației Ruse.
În sediul unei entități de comerț cu amănuntul destinat fabricării de medicamente, suprafețele pereților și tavanelor trebuie să fie netede, fără a compromite integritatea stratului de acoperire (vopsele impermeabile, emailuri sau plăci smălțuite deschise), finisate cu materiale care să permită curățare umedă cu dezinfectanți (plăci ceramice nesălțuite, linoleum cu sudură obligatorie a cusăturilor sau a altor materiale).
Joncțiunea pereților cu tavanul și podeaua nu trebuie să aibă adâncituri, proeminențe sau cornișe.
O entitate de comerț cu amănuntul trebuie să prevadă posibilitatea de a asigura intrarea și ieșirea nestingherite pentru persoanele cu dizabilități, în conformitate cu cerințele legislației privind protecția persoanelor cu dizabilități.
În cazul în care caracteristica de proiectare a clădirii nu permite amenajarea intrării și ieșirii pentru persoanele cu dizabilități, entitatea de comerț cu amănuntul trebuie să organizeze posibilitatea apelării unui farmacist pentru a deservi aceste persoane.
O entitate de comerț cu amănuntul trebuie să aibă un semn care să indice:
a) tipul de organizație de farmacie în limba rusă și în limbile naționale: „Farmacie” sau „Punctul de farmacie” sau „Chioșc de farmacie”;
b) denumirea completă și (dacă există) prescurtată, inclusiv denumirea companiei și forma organizatorică și juridică a entității comerciale cu amănuntul;
c) modul de operare.
O entitate de comerț cu amănuntul care vinde produse farmaceutice pe timp de noapte trebuie să aibă un panou iluminat cu informații despre lucrul pe timp de noapte.
Atunci când o entitate comercială cu amănuntul este situată în interiorul unei clădiri, semnul trebuie să fie amplasat pe peretele exterior al clădirii; dacă acest lucru nu este posibil, este permisă instalarea unui semn, ale cărui cerințe sunt similare cu cerințele pentru un semn. .
Echipamente.
O entitate de comerț cu amănuntul trebuie să aibă echipamente și inventar care să asigure păstrarea calității, eficienței și siguranței produselor farmaceutice.
Spațiile pentru depozitarea medicamentelor ar trebui să fie echipate cu echipamente care să permită depozitarea acestora ținând cont de cerințele de bună practică pentru depozitarea și transportul medicamentelor.
Echipamentele utilizate de o entitate de comerț cu amănuntul trebuie să aibă pașapoarte tehnice care sunt păstrate pe toată perioada de funcționare a echipamentului.
Spațiile, precum și echipamentele utilizate de o entitate comercială cu amănuntul atunci când desfășoară activități, trebuie să îndeplinească cerințele sanitare, siguranța la incendiu și reglementările de siguranță în conformitate cu legislația Federației Ruse.
Echipamentele trebuie instalate la o distanță de cel puțin 0,5 metri de pereți sau alte echipamente pentru a avea acces pentru curățare, dezinfectare, reparare, întreținere, verificare și (sau) calibrare a echipamentelor, pentru a asigura accesul la produsele farmaceutice și trecerea liberă. pentru lucrători (în acest caz, dacă nu este posibilă menținerea distanței specificate de 0,5 metri, atenția principală trebuie acordată esenței acestui punct: trebuie să existe acces pentru curățare, dezinfectare, reparații, trecere liberă a lucrătorilor, etc.).
Echipamentul nu trebuie să blocheze sursele de lumină naturală sau artificială și
blocați pasajele.
Sediul și (sau) zona de vânzare cu amănuntul trebuie să fie echipate cu vitrine, rafturi (gondole) - cu un afișaj deschis de mărfuri, oferind posibilitatea de a revizui produsele farmaceutice permise spre vânzare, precum și să ofere confort în muncă pentru angajații comerțului cu amănuntul. entitate comercială.
IV. Procese de operare cheie (SOP).
Principalele procese ale unei organizații de farmacie sunt împărțite în 7 blocuri:
- Cerințe generale;
- Achizitie;
- Acceptare;
- Pregatire inainte de vanzare;
- Depozitare;
- Implementare;
- Control de calitate.
Cerințe generale.
Toate procesele unei entități de comerț cu amănuntul care afectează calitatea, eficiența și siguranța produselor farmaceutice sunt efectuate în conformitate cu procedurile standard de operare aprobate.
Cumpărare.
Șeful unei entități de comerț cu amănuntul trebuie să aprobe procedura de selectare și evaluare a furnizorilor de produse farmaceutice, luând în considerare, printre altele, următoarele criterii:
a) conformitatea furnizorului cu cerințele legislației actuale a Federației Ruse privind acordarea de licențe pentru anumite tipuri de activități;
b) reputația de afaceri a furnizorului pe piața farmaceutică, pe baza prezenței faptelor de rechemare a produselor farmaceutice falsificate, substandard, contrafăcute, a neîndeplinirii obligațiilor contractuale acceptate, a ordinelor organelor de control de stat autorizate cu privire la fapte de încălcare a cerințelor; a legislației Federației Ruse;
c) cererea de produse farmaceutice oferite de furnizor pentru vânzare ulterioară, conformitatea calității produselor farmaceutice cu cerințele legislației Federației Ruse;
d) respectarea de către furnizor a cerințelor stabilite prin regulile PNA pentru întocmirea documentației, disponibilitatea unui document cu o listă de declarații de conformitate a produsului cu cerințele stabilite, un protocol pentru convenirea prețurilor la medicamentele incluse în lista de medicamente vitale și esențiale;
e) respectarea de către furnizor a condițiilor de temperatură în timpul transportului medicamentelor termolabile, inclusiv medicamentelor imunobiologice;
f) furnizarea de către furnizor a unei garanții de calitate pentru produsele farmaceutice furnizate;
g) competitivitatea clauzelor contractuale oferite de furnizor;
h) fezabilitatea economică a termenelor de livrare a mărfurilor propuse de furnizor (număr de colete furnizate, cantitate minimă de livrare);
i) capacitatea de a furniza o gamă largă;
j) respectarea termenului de livrare cu timpul de lucru al entității de comerț cu amănuntul.
Entitatea comercială cu amănuntul și furnizorul încheie un acord ținând cont de cerințele legislației privind fundamentele reglementării de stat a activităților comerciale în Federația Rusă, precum și ținând cont de cerințele legislației civile, care stipulează termenele limită pentru furnizorul să accepte pretenții cu privire la calitatea produsului, precum și posibilitatea de a returna furnizorului produse farmaceutice falsificate, de calitate scăzută, contrafăcute, în cazul în care informațiile despre aceasta au fost primite după acceptarea mărfurilor și executarea documentelor relevante.
În ceea ce privește produsele farmaceutice (cu excepția produselor medicale), unei entități de comerț cu amănuntul i se permite să furnizeze furnizorului servicii pe bază de rambursare, al căror obiect este realizarea acțiunilor care sunt benefice din punct de vedere economic pentru furnizor și ajută la creșterea vânzărilor de farmacie. produse (cu excepția produselor medicale) și fidelizarea clienților.
Furnizorul decide în mod independent dacă trebuie să achiziționeze astfel de servicii, iar impunerea unor astfel de servicii furnizorului de către o entitate de comerț cu amănuntul nu este permisă.
Achiziționarea de produse farmaceutice de către o entitate de comerț cu amănuntul înființată sub forma unei întreprinderi unitare de stat și municipale se realizează în conformitate cu cerințele legislației Federației Ruse privind sistemul contractual în domeniul achizițiilor de bunuri, lucrări, servicii pentru satisfacerea nevoilor de stat și municipale.
Acceptare.
Acceptarea produselor farmaceutice este efectuată de o persoană responsabilă financiar (trebuie să existe un ordin intern de desemnare a acestei persoane).
În procesul de acceptare a mărfurilor farmaceutice, inclusiv a celor care necesită condiții speciale de depozitare și măsuri de siguranță, conformitatea mărfurilor acceptate cu documentația de expediere în ceea ce privește sortimentul, cantitatea și calitatea, respectarea condițiilor speciale de depozitare (dacă există o astfel de cerință) , și se efectuează verificarea deteriorării containerului de transport.
Competența unei entități de comerț cu amănuntul de a verifica calitatea produselor farmaceutice furnizate este limitată la o inspecție vizuală a aspectului, verificarea conformității cu documentele însoțitoare, a caracterului complet al setului de documente însoțitoare, inclusiv registrul documentelor care confirmă calitatea produselor farmaceutice. .
O entitate de comerț cu amănuntul trebuie să țină cont de specificul acceptării și inspecției înainte de vânzare a produselor farmaceutice (de exemplu, dacă un produs necesită depozitare la o temperatură de 2-8°C, este necesar să se asigure imediat conformitatea cu această cerință și mutați produsul specificat la frigider). În acest caz, trebuie menționat că termenul „produse farmaceutice” se referă atât la medicamente, cât și la produse nemedicinale.
Dacă produsele farmaceutice sunt în containere de transport fără deteriorare, atunci acceptarea poate fi efectuată după numărul de locuri sau după numărul de unități de produs și marcajele de pe container.
În cazul în care cantitatea și calitatea produselor farmaceutice corespund cu cele specificate în documentele însoțitoare, atunci pe documentele însoțitoare se aplică o ștampilă de acceptare (bilet, factură, conosament, registru de documente de calitate și alte documente care atestă cantitatea sau calitatea mărfurilor). primit) confirmarea faptului de conformitate a produselor farmaceutice acceptate cu datele specificate în documentele însoțitoare.
Întrebare frecventă: este necesar să aveți ștampila de acceptare la farmacie? Regulile NAP impun prezența unei astfel de ștampile.
Persoana responsabilă financiar care acceptă produse farmaceutice își pune semnătura pe documentele însoțitoare și o certifică cu sigiliul entității de comerț cu amănuntul (dacă există).
Dacă nu se verifică disponibilitatea reală a produselor farmaceutice în containere, atunci este necesar să se noteze acest lucru în documentul de însoțire.
În caz de nerespectare mărfuri sortimentare farmaceutice furnizate unei entități de comerț cu amănuntul, termenii contractului și documentele însoțitoare, comisia entității de comerț cu amănuntul, în conformitate cu procedura standard de operare aprobată, întocmește un act, care stă la baza depunerii reclamațiilor furnizorului (întocmirea actului unilateral de către persoana responsabilă financiar este posibilă cu acordul furnizorului sau lipsa reprezentantului acestuia).
Procesul-verbal se întocmește unilateral numai dacă furnizorul este de acord cu neconformitatea identificată sau nu există un reprezentant al furnizorului.
Entitatea comercială cu amănuntul, de comun acord cu furnizorul, poate aproba o altă metodă de notificare a furnizorului cu privire la neconformitatea produselor farmaceutice furnizate cu documentele însoțitoare.
Această opțiune de notificare trebuie, de asemenea, să fie aprobată printr-un ordin intern al organizației și inclusă în procedurile standard de operare.
Anterior, vorbeam în general despre produse farmaceutice. În ceea ce privește în special medicamentele, indiferent de sursa lor de aprovizionare, acestea sunt supuse controlului de acceptare pentru a preveni comercializarea medicamentelor contrafăcute, substandard și contrafăcute.
Controlul acceptării constă în verificarea produselor medicamentoase primite prin evaluarea:
a) aspect, culoare, miros;
b) integritatea ambalajului;
c) conformitatea etichetării medicamentelor cu cerințele stabilite de legislația privind circulația medicamentelor;
d) executarea corectă a documentelor însoțitoare;
e) prezența unui registru de declarații care confirmă calitatea medicamentelor în conformitate cu documentele de reglementare în vigoare.
De remarcat faptul că pentru efectuarea controlului de acceptare se creează un comitet de acceptare prin ordin intern al conducătorului entității de comerț cu amănuntul.
Membrii comisiei trebuie să cunoască toate actele legislative și alte acte normative ale Federației Ruse care definesc cerințele de bază pentru produsele farmaceutice, execuția documentelor însoțitoare și caracterul complet al acestora.
Informațiile privind controlul acceptării sunt reflectate într-un jurnal, care este păstrat în formă liberă și poate fi atât în versiune tipărită, cât și în versiune electronică.
Nu este necesară păstrarea oricărui alt document care confirmă efectuarea controlului de recepție, conform regulilor PNA.
Pregătire înainte de vânzare.
Înainte de a fi livrate în zona de vânzare, produsele farmaceutice trebuie să fie supuse pregătirii înainte de vânzare, care include:
- despachetarea,
- sortarea
- inspectie,
- verificarea calitatii produsului (prin semne externe),
- verificarea disponibilitatii informatiilor necesare despre produs si furnizorul acestuia.
Produsele alimentare medicale, pentru bebeluși și dietetice, aditivii biologic activi sunt produse alimentare care, înainte de a fi livrate într-o zonă comercială sau alt loc de comerț, trebuie eliberate de recipiente, materiale de ambalare și legare și cleme metalice.
Entitatea de comerț cu amănuntul trebuie, de asemenea, să verifice calitatea produselor alimentare medicale, pentru bebeluși și dietetice, a suplimentelor alimentare pe baza semnelor externe, să verifice disponibilitatea documentației și informațiilor necesare și să efectueze respingerea și sortarea.
Comerțul cu produse alimentare medicale, pentru copii și dietetice, aditivi biologic activi este interzis dacă integritatea ambalajului este încălcată.
Calitatea acestui grup de mărfuri este confirmată printr-un certificat de înregistrare de stat, care indică domeniul de aplicare și utilizare, și un document de la producător și (sau) furnizor care confirmă siguranța produsului, o declarație de conformitate a calității sau o registrul declaratiilor.
În cazul încălcării integrității ambalajului sau lipsei unui pachet complet de documente, produse alimentare medicale, pentru bebeluși și dietetice, suplimentele alimentare trebuie returnate furnizorului.
Dezinfectanții, înainte de a fi furnizați în zona de vânzare sau plasați la punctul de vânzare, trebuie să fie supuși unei pregătiri înainte de vânzare, care include:
- scutire de ambalaj de transport,
- sortare,
- verificarea integrității ambalajului (inclusiv a funcționării ambalajului pentru aerosoli),
- verificarea calitatii marfii prin semne externe,
- verificarea disponibilității informațiilor necesare despre dezinfectanți și producătorul acestora,
- verificarea instructiunilor de utilizare.
Parfumurile și produsele cosmetice furnizate zonei comerciale trebuie să respecte cerințele stabilite prin Decizia Comisiei Uniunii Vamale din 23 septembrie 2011 N 799 „Cu privire la adoptarea reglementărilor tehnice ale Uniunii Vamale „Cu privire la siguranța parfumurilor și cosmeticelor”. produse".
Depozitare.
Informațiile de bază privind depozitarea sunt specificate în Fondul Civil XIII, Ordinul 706n și Ordinul 646n. Cu toate acestea, regulile PNA prevăd și unele reguli de depozitare care ar trebui luate în considerare.
Conform regulilor NAP, afișarea deschisă a medicamentelor fără prescripție medicală și a altor produse farmaceutice este permisă (în consecință, afișarea deschisă nu se aplică medicamentelor eliberate pe bază de rețetă).
Medicamentele vândute fără prescripție medicală sunt plasate pe vitrine ținând cont de condițiile de păstrare prevăzute în instrucțiunile de uz medical și (sau) pe ambalaj.
Medicamentele eliberate pe bază de rețetă pot fi păstrate în vitrine, în vitrine și dulapuri deschise, cu condiția ca clienții să nu aibă acces la ele.
Produsele medicamentoase eliberate pe bază de rețetă sunt găzduite separat de produsele medicamentoase fără prescripție medicală, în dulapuri încuiate, cu „medicamentul eliberat pe bază de rețetă” marcat pe raftul sau dulapul în care sunt depozitate astfel de medicamente.
Implementarea.
Comerțul cu amănuntul al produselor farmaceutice include vânzări, distribuție și consultanță farmaceutică.
Pentru a oferi servicii de consultanță farmaceutică, este permisă alocarea unei zone speciale, inclusiv pentru așteptarea consumatorilor, cu instalarea sau desemnarea limitatoarelor speciale și organizarea locurilor.
Șeful organizației de farmacie, antreprenor individual, asigură disponibilitatea unui sortiment minim.
În zona comercială, într-un loc convenabil pentru vizionare, se află următoarele:
a) o copie a licenței pentru activități farmaceutice;
b) o copie a licenței pentru traficul de stupefiante, substanțe psihotrope și precursori ai acestora, cultivarea plantelor stupefiante (dacă există);
c) informații despre imposibilitatea returnării și schimbului de produse farmaceutice de calitate corespunzătoare;
d) alte documente si informatii care trebuie aduse la cunostinta cumparatorilor.
Fiecare entitate de comerț cu amănuntul trebuie să aibă o carte de recenzii și sugestii, care este furnizată cumpărătorului la cererea acestuia (ceea ce nu implică amplasarea obligatorie a acestuia pe stand).
Informațiile despre medicamentele eliberate fără prescripție medicală pot fi plasate pe raft sub formă de poster, wobbler și alte medii de informare pentru a oferi cumpărătorului posibilitatea de a alege în cunoștință de cauză un produs farmaceutic, de a obține informații despre producător. , modalitatea de utilizare a acestuia si in vederea pastrarii aspectului produsului .
De asemenea, într-un loc convenabil pentru vizionare, trebuie plasată o etichetă de preț care să indice:
- nume,
- doze,
- numărul de doze din ambalaj,
- țara de origine,
- data expirării (dacă este disponibilă).
(Principalele cerințe pentru etichetele de preț sunt, de asemenea, stabilite în Decretul Guvernului Federației Ruse din 19 ianuarie 1998 N55 „Cu privire la aprobarea Regulilor pentru vânzarea anumitor tipuri de bunuri, o listă de bunuri de folosință îndelungată care nu sunt sub rezerva cerinței cumpărătorului de a-i furniza gratuit pentru perioada de reparare sau înlocuire a unui produs similar și o listă a produselor nealimentare de bună calitate care nu pot fi returnate sau schimbate cu un produs similar de o dimensiune, formă diferită, dimensiune, stil, culoare sau configurație").
Atunci când vinde medicamente, un lucrător farmaceutic nu are dreptul de a ascunde de la cumpărător informații despre disponibilitatea altor medicamente care au aceeași denumire comună internațională și prețurile acestora în raport cu cel solicitat.
Comerțul cu amănuntul cu produse farmaceutice care nu au legătură cu medicamente poate fi efectuat de către angajații care nu au studii farmaceutice sau studii profesionale suplimentare în comerțul cu amănuntul al medicamentelor dacă lucrează în secții separate (ambulatori, secții paramedic și paramedic-obstetricale). , centre (departamente) ) medicină generală (de familie)) organizații medicale autorizate să desfășoare activități farmaceutice și situate în mediul rural unde nu există farmacii.
La cererea cumpărătorului, lucrătorul farmaceutic trebuie să-l familiarizeze cu documentația de însoțire a produsului, care să conțină pentru fiecare denumire de produs informații privind confirmarea obligatorie a conformității în conformitate cu legislația Federației Ruse privind reglementările tehnice.
- certificat de conformitate,
- numărul lui,
- perioada de valabilitate a acestuia,
- autoritatea care a eliberat certificatul, sau
- informații despre declarația de conformitate,
- inclusiv numărul său de înregistrare,
- perioada de valabilitate a acestuia,
- numele persoanei care a acceptat declarația și
- organismul care l-a înregistrat.
Aceste documente trebuie certificate prin semnătura și sigiliul (dacă există) furnizorului sau vânzătorului, indicând adresa locației acestuia și numărul de telefon de contact.
Control de calitate.
Șeful unei entități de comerț cu amănuntul trebuie să monitorizeze parametrii cantitativi și calitativi ai produselor farmaceutice achiziționate, precum și momentul livrării acestora în conformitate cu contractele încheiate în conformitate cu cerințele legislației Federației Ruse.
Șeful unei entități de comerț cu amănuntul trebuie să asigure identificarea produselor farmaceutice care nu îndeplinesc cerințele documentației de reglementare pentru a preveni utilizarea sau vânzarea neintenționată a acestora.
Produsele farmaceutice falsificate, substandard, contrafăcute trebuie identificate și izolate de alte produse farmaceutice în conformitate cu procedurile standard de operare.
Etichetarea, amplasarea și metodele de delimitare a unei zone de carantină, precum și persoana responsabilă cu lucrul cu produsele farmaceutice specificate, se stabilesc prin ordin al conducătorului unității de comerț cu amănuntul.
Șeful unei entități de comerț cu amănuntul efectuează o evaluare a activităților pentru a verifica caracterul complet al conformității cu cerințele stabilite prin prezentele Reguli și pentru a determina acțiuni corective.
V. Audit intern (vă va ajuta să vă organizați corect munca, fără încălcări și să preveniți greșelile)
Se efectuează un audit intern pentru a identifica deficiențele în conformitate cu cerințele legislației Federației Ruse și pentru a face recomandări pentru acțiuni corective și preventive.
Programul de audit intern ar trebui să țină seama de rezultatele auditurilor și inspecțiilor interne anterioare efectuate de autoritățile de reglementare.
Auditul intern trebuie efectuat independent și cu atenție de către persoane special desemnate de șeful entității de comerț cu amănuntul, care fac parte din personalul entității de comerț cu amănuntul și (sau) angajate pe bază contractuală (care este, de asemenea, stabilită de un Ordin).
Prin decizia conducătorului unei entități de comerț cu amănuntul, poate fi efectuat un audit independent, inclusiv de către experți de la entități terțe de comerț cu amănuntul.
Rezultatele auditului intern sunt documentate. Documentele întocmite în urma auditului trebuie să cuprindă toate informațiile obținute și propunerile de acțiuni corective necesare. Măsurile luate pe baza rezultatelor auditului intern sunt, de asemenea, documentate.
Astfel, principalele informații care ar trebui să fie conținute în documentele de audit intern includ următoarele elemente:
- cine efectuează auditul;
- când se efectuează auditul;
- program de audit;
- ce a fost dezvăluit în timpul auditului intern;
- măsurile luate pe baza rezultatelor auditului intern.
Persoana responsabilă cu domeniul de activitate al entității de comerț cu amănuntul care este inspectată trebuie să se asigure că sunt luate imediat măsuri corective și preventive.
Acțiunile ulterioare ar trebui să includă un audit al acțiunilor corective și preventive întreprinse și un raport privind rezultatele acțiunilor întreprinse și eficacitatea acestora.
Șeful unei entități de comerț cu amănuntul trebuie să îmbunătățească constant eficacitatea sistemului calității, folosind, printre altele, rezultatele auditului intern, analizei datelor, acțiunilor corective și preventive.
pentru studenții din anul IV ai Facultății de Farmacie și FPIG pe tema lecției:
Politica de cumpărare și vânzări a unei organizații de farmacie
Plan
Obiectivele și scopurile politicii de cumpărare a unei organizații de farmacie. Formarea unei piețe pentru oferte comerciale.
Rolul intermediarilor comerciali în distribuția mărfurilor.
Activitățile de cumpărare ale unei organizații de farmacie: documentarea operațiunilor de cumpărare. Acord. Structura contractului.
Strategia de vânzări a unei organizații de farmacie. Programul FOSSTIS.
Obiectivele și scopurile politicii de cumpărare a unei organizații de farmacie. Formarea unei piețe pentru oferte comerciale
Sarcina principală a organizațiilor de farmacie este furnizarea neîntreruptă a populației și a organizațiilor de asistență medicală cu medicamente, produse medicale, echipamente medicale și alte produse farmaceutice eficiente, sigure și de înaltă calitate. Pe de altă parte, scopul activității, ca orice organizație comercială, este acela de a obține profit. În acest sens, o atenție deosebită trebuie acordată organizării distribuției produselor, formării activităților de cumpărare și politicii de vânzări a organizației și răspunsului prompt la schimbările cererii consumatorilor.
Baza politica de achizitii– eficiența și promptitudinea livrării mărfurilor. Eficacitatea politicii de achiziții este înțeleasă ca extinderea scarii de activitate, asigurarea unei poziții competitive puternice a organizației pe piață și obținerea de profituri țintă prin optimizarea costurilor de achiziție.
Pentru a evalua eficacitatea unei politici de achiziții, este recomandabil să se utilizeze o abordare multicriterială, bazată pe faptul că criteriul pentru eficacitatea unei politici de achiziții este gradul în care obiectivele acesteia sunt atinse. Obiectivele politicii de cumpărare a organizațiilor sunt împărțite în patru grupe principale: obiective de calitate, costuri, lichiditate, fiabilitate.
Obiective de calitate indicați cerințele pentru proprietățile bunurilor achiziționate. Întrucât calitatea mărfurilor achiziționate este o condiție pentru asigurarea calității produselor vândute, acest obiectiv are o semnificație independentă în achiziție. Indicatorii eficacității politicii de cumpărare în atingerea obiectivului de asigurare a nivelului necesar de calitate a sortimentului includ: volumul cifrei de afaceri cu amănuntul, dinamica cifrei de afaceri cu amănuntul, numărul de soiuri de sortiment, rata de reînnoire a sortimentului și nivelul cifrei de afaceri. În considerarea acestui aspect al politicii de achiziții, este indicat să se includă ca indicatori de calitate nu doar nivelul de calitate al produselor furnizate, ci și nivelul calității serviciului către organizația comercială de la furnizor, ponderea comenzilor finalizate în în conformitate cu cerințele, progresivitatea ambalării produselor furnizate, precum și nivelul calității serviciilor conexe.
Goluri optimizarea costurilor: iau în considerare nu numai costurile cauzate de activitățile de achiziție, ci sunt considerate în raport cu costurile totale ale organizației. Indicatorii eficacității politicii de achiziții în atingerea obiectivului de minimizare a costurilor includ nivelul costurilor de achiziție și nivelul general al costurilor de distribuție.
Obiective de lichiditate sunt cauzate de necesitatea de a atrage resurse financiare pentru achiziționarea de bunuri. Aceste obligații reduc lichiditatea organizației, astfel încât implicațiile de lichiditate ale achiziției trebuie luate în considerare. Indicatorii eficacității atingerii unui anumit nivel de lichiditate includ: indicatori ai structurii activelor circulante, raportul dintre conturile de plătit și de încasat și indicatorul randamentului capitalului de lucru.
Obiective de fiabilitate rezultă din faptul că funcţiile de aprovizionare şi vânzări trebuie coordonate. Poate fi luat în considerare sub diferite aspecte: fiabilitatea furnizorilor, fiabilitatea serviciului, fiabilitatea proceselor de depozitare și transport etc. Indicatorii nivelului dorit de fiabilitate a aprovizionării includ: numărul de furnizori, ponderea furnizorilor cu mărci comerciale, gradul de stabilitate în încheierea contractelor, gradul de pregătire a furnizorului pentru livrarea la timp; fiabilitatea aprovizionării; gradul de pregătire pentru livrare imediată (ponderea cererii totale de produse, a cărei satisfacție prin livrare poate fi realizată imediat), flexibilitatea livrării (pregătirea întreprinderii de a îndeplini modificările aduse de consumator la comandă).
Principalii factori care reduc eficiența gestionării activităților de achiziții ale organizațiilor comerciale în etapa actuală includ:
Situația financiară instabilă a organizațiilor comerciale;
Puterea de cumpărare scăzută a populației;
În unele cazuri, incapacitatea de a anticipa cererea pentru anumite tipuri de bunuri, ceea ce duce la adoptarea unor decizii de management nefondate în domeniul achiziționării de bunuri.
Una dintre cele mai promițătoare modalități de a atinge aceste obiective este diversificarea activităților de achiziții. Diversificarea (novolat. diversificare- schimbare, diversitate; din lat. diversus- diferită şi facere- do) - extinderea gamei de produse și reorientarea piețelor de desfacere, dezvoltarea de noi tipuri de producție pentru a crește eficiența producției, a obține beneficii economice și a preveni falimentul.
Care sunt asemănările și diferențele dintre politici, standarde și proceduri de operare? Nu toată lumea poate răspunde la această întrebare. Se pare că există o înțelegere generală, dar diavolul este în detalii și detaliile sunt cele care în cele din urmă creează diferența de înțelegere. Diferența de înțelegere, la rândul său, are ca rezultat așteptări nejustificate și timp pierdut.
Politici, standarde și proceduri. Care este diferența?
Politicienii
Politica este o colecție de principii pe care o companie le urmează în activitățile sale. Principiile sunt de fapt regulile de comportament adoptate în companie. Sper că înțelegeți că prezența unui principiu exprimat nu înseamnă că este respectat cu strictețe? Pentru că uneori am observat o situație în care crearea unei politici și implementarea acesteia erau considerate identice. Dar asta este o cu totul altă poveste. Pentru moment, ne vom uita doar la ce sunt politicile, standardele și procedurile.
Cu toate acestea, mă abat. Să revenim la politică.
Regulile de conduită și de luare a deciziilor prevăzute în politică se pot referi la diferite domenii de activitate. De exemplu:
- Politica de comunicare internă
- Politica de calitate
- Politica de servicii pentru clienți
- Politica de securitate a informațiilor
- Politica de management financiar
- Politica de management al proceselor de afaceri
Fiecare dintre exemplele de mai sus definește comportamentul dorit al unei companii într-o anumită zonă.
Se dovedește că o companie poate avea multe politici - o politică pentru fiecare domeniu de activitate. Bine, câți ar trebui să fie în acest caz? Pentru ce domenii de activitate ar trebui create politici? Este imposibil să răspundem fără echivoc la această întrebare. Cert este că politicile sunt create pentru acele domenii care sunt cheie din punctul de vedere al strategiei companiei. Și fiecare are propria strategie. Deci numai tu poți determina setul și componența politicilor.
Nu este necesar să se creeze o politică pentru fiecare domeniu cheie. Este pe deplin acceptabil să folosiți o singură politică care să încorporeze principiile necesare din diferite domenii de activitate. În acest fel, puteți crea pur și simplu o listă de întrebări operaționale cheie, puteți formula răspunsuri la acestea și le puteți compila într-o politică corporativă.
O politică bună, în plus față de răspunsul la întrebarea „cum să acționezi în acest sau acel caz”, oferă un răspuns la întrebarea „de ce ar trebui să se facă acest lucru”.
În companiile de succes, politicile sunt scrise și adoptate de consiliul de administrație sau de o reuniune a directorilor deoarece În ultimă instanță, aceștia sunt responsabili pentru întreaga companie și pentru fiecare angajat în parte.
Problema managementului politicilor a primit destul de multă atenție. Și acest lucru este complet justificat.
Apropo, dacă utilizați deja politici în companie, asigurați-vă că există o politică corespunzătoare care guvernează modificările tuturor celorlalte. În caz contrar, schimbarea politicilor va deveni haotică și va anula toate eforturile de a le crea. Rețineți că o modificare a politicii trebuie să fie convenită și semnată de toți cei care au acceptat anterior politica.
Standarde
În timp ce politicile acoperă probleme în întreaga companie, standardele stabilesc reguli și proceduri de control care ajută politicile să fie urmate în mod continuu. Standardele sunt ceea ce trebuie să facă toți angajații pentru a implementa politicile. Un standard reglementează o problemă specifică, astfel încât o companie poate (și cel mai probabil va avea) multe standarde. De exemplu, GOST-urile. Un GOST reglementează o singură problemă. De exemplu, există un întreg bloc de GOST-uri privind documentația de lucru pentru construcție. Dar pentru fiecare întrebare specifică există un standard:
- Sistem de documente de proiectare pentru constructii. Cerințe de bază pentru proiectare și documentație de lucru
- Sistem de documente de proiectare pentru constructii. Date generale despre desenele de lucru
- Sistem de documente de proiectare pentru constructii. Specificații
- Sistem de documente de proiectare pentru constructii. Simboluri pentru conductele sistemelor sanitare
Pentru exemplul de mai sus, politica se va ocupa de aspecte generale ale gestionării documentației de proiect pentru construcție, iar standardele vor specifica aspecte specifice.
Există, totuși, o excepție în realitatea rusă. Companiile care operează la nivel internațional sunt adesea forțate să respecte două standarde de raportare financiară - RAS și IFRS. Dar aceasta este o excepție.
Standardele tehnice conțin specificații pe care diferiți producători le folosesc pentru a se asigura că componentele sau dispozitivele pot fi utilizate împreună sau pot fi compatibile între ele.
Standardele pot fi foarte specifice și se aplică doar unei singure companii. Dar fiecare standard este format pe baza celei mai bune experiențe - experiența companiei sau a industriei. Adesea, standardele din anumite industrii și zone sunt adaptate pentru altele. De exemplu, standardele de siguranță.
Adesea, standardele vizează asigurarea siguranței angajaților și protejarea activelor fizice și informaționale ale companiei.
Respectarea standardelor este obligatorie.
La fel ca politicile, standardele trebuie gestionate de un grup de experți în domeniul de aplicare al standardului. Prin urmare, este complet greșit atunci când, de exemplu, departamentul de resurse umane gestionează standardul pentru securitatea muncii la locul de muncă. Și acesta nu este cel mai „dur” exemplu.
Schimbările aduse standardelor trebuie, de asemenea, guvernate într-un mod clar și ușor de înțeles.
Proceduri
Putem spune că procedurile sunt instrucțiuni care spun cum să se efectueze acțiuni. Standardele și procedurile corecte sunt transversale, de exemplu. reflectă modul în care anumite operațiuni ar trebui efectuate pas cu pas într-o viziune mai largă a politicilor și standardelor. Procedurile pot fi aplicate și gestionate local, de exemplu în cadrul unui singur departament sau chiar al unui singur post. Adevărat, acest lucru nu înseamnă că modificările în proceduri pot avea loc în conformitate cu principii diferite decât schimbările în politici și standarde. În orice caz, procedura de modificare trebuie să includă o analiză cuprinzătoare a impactului asupra rezultatelor și progresului procedurii. O procedură ca parte a unui proces are un rezultat specific, care are un client. Acest lucru trebuie reținut atunci când gestionați proceduri. De asemenea, este necesar să ne amintim să respectați interesele participanților la procedură.
Nu este nevoie să se implice organele de conducere de vârf, cum ar fi consiliul de administrație, pentru a gestiona procedurile. Cu toate acestea, la aprobarea procedurilor trebuie să participe reprezentanți interesați ai managementului de mijloc. Permiteți-mi să vă reamintesc că procedurile sunt legate de standarde și politici mai înalte, așa că schimbarea procedurilor poate afecta interesele în ambele direcții.
Procedura din punct de vedere al procesului
În managementul proceselor de afaceri, conceptul de procedură este ușor diferit de cel general acceptat. Din punctul nostru de vedere, o procedură este o succesiune liniară de operații. Procedura vă permite să afișați o secvență de acțiuni sub forma unei liste simple și, prin urmare, să simplificați descrierea procesului de afaceri.
Elemente comune
Cerințele generale de documentare cresc probabilitatea înțelegerii și executării corecte a documentelor.
Claritate
Politicile, standardele și procedurile trebuie scrise într-un limbaj clar, pe care toată lumea să-l poată înțelege. Aceasta este o cerință obligatorie și fundamentală. Deși diferite persoane înțeleg informațiile în mod diferit, este important să ne asigurăm că documentele sunt înțelese pentru o gamă largă de utilizatori. Personal, formulez cerința astfel: documentul trebuie să fie înțeles de omul obișnuit de pe stradă. Aceasta înseamnă că un specialist care are un set de cunoștințe de bază în domeniul subiectului ar trebui să înțeleagă cu ușurință ce este scris în document și ce să facă cu el.
Această cerință include, de asemenea, utilizarea unui limbaj cel mai simplu și mai viu posibil. Cu cât este scris mai simplu, cu atât este mai ușor perceput. Nu uitați să respectați regulile gramaticale.
Uniformitate
Nu transforma documentele în benzi desenate. Când varietatea de imagini, fonturi, culori și stiluri de design începe să vă uimească ochii. Alegeți stiluri simple și păstrați elementele consistente. Dacă fontul aldin este folosit pentru a evidenția definițiile, atunci nu este potrivit pentru a sublinia ideile cheie. Mărimea titlurilor ar trebui să fie aceeași pentru nivelul de titlu corespunzător. Nu faceți titluri de același nivel multicolore etc.
Relaţie
Legătura dintre documente trebuie urmărită în fiecare document. Cu alte cuvinte, dacă o procedură sprijină implementarea unui anumit standard, care, la rândul său, reflectă funcționarea politicii, acest lucru ar trebui să fie clar din document. O schimbare a procedurii va duce în cele din urmă la o schimbare a politicii și invers. Ar trebui să existe o ierarhie în documentație. Utilizarea legăturilor interactive simplifică foarte mult procesul de lucru cu documentația.
Stocare unică
Astăzi, multe companii suferă de un dezavantaj asociat cu stocarea informațiilor - lipsa unei singure facilitati de stocare online. Toate politicile, standardele și procedurile ar trebui să fie într-un singur loc pe care să îl poată accesa angajații interesați. Accesul trebuie să fie lizibil, dar nu editat. Da, este posibil (și uneori necesar) să diferențiezi drepturile de citire a documentației.
Editarea documentației poate fi deschisă numai persoanelor responsabile. Drepturile de modificare a documentelor trebuie, de asemenea, configurate pe baza rutei de aprobare. Adică, un document poate fi schimbat într-un depozit online doar dacă a fost agreat de toți responsabilii.
Căutarea după numele documentelor și conținutul acestora trebuie să funcționeze. Sistemul de etichetare este binevenit. Harta de documentare – acrobație.
Disponibilitatea documentației justificative
Acest tip de document este adesea uitat. Acest tip include instrucțiuni, foi de verificare, descrieri ale metodelor de calcul etc. Aceste documente sunt concepute pentru a ajuta angajații să efectueze anumite procese, proceduri etc. Foarte des, lipsa instrucțiunilor tehnice este un obstacol foarte serios în calea implementării cu succes și a utilizării eficiente a unui anumit instrument.
Într-un alt articol cu siguranță voi vorbi despre întreaga structură.
„Cu privire la aprobarea regulilor de bună practică în farmacie a medicamentelor de uz medical”
Revizuire din 31.08.2016 — Valabil de la 01.03.2017
MINISTERUL SĂNĂTĂȚII AL FEDERĂȚIA RUSĂ
ORDIN
din data de 31 august 2016 N 647n
PRIVIND APROBAREA REGULAMENTULUI DE BUNE PRACTICĂ FARMACIALĂ PENTRU MEDICAMENTE DE UTILIZARE MEDICALĂ
1. Aprobați Regulile de bună practică farmaceutică atașate pentru medicamentele de uz medical.
Ministru interimar
ÎN. KAGHRAMANYAN
APROBAT
prin ordin al Ministerului Sănătăţii
Federația Rusă
din data de 31 august 2016 N 647n
REGULI DE BUNE PRACTICĂ FARMACIALĂ PENTRU MEDICAMENTE DE UZ MEDICAL
I. Dispoziţii generale
1. Prezentele Reguli de bună practică în farmacie a medicamentelor de uz medical (denumite în continuare Reguli, medicamente) stabilesc cerințe pentru comerțul cu amănuntul de către organizațiile de farmacie, întreprinzătorii individuali cu licență pentru activități farmaceutice, organizațiile medicale cu licență pentru produse farmaceutice. activitățile și unitățile separate ale acestora (ambulatori, centre paramedic și paramedic-obstetricale, centre (departamente) de medicină generală (de familie) situate în localități rurale în care nu există organizații de farmacie (denumite în continuare entități de comerț cu amănuntul); precum și organizațiile de farmacie și organizațiile medicale sau subdiviziunile lor separate situate în așezări rurale și zone îndepărtate de zonele populate în care nu există organizații de farmacie, dacă organizațiile de farmacie, organizațiile medicale sau subdiviziunile lor separate au o licență prevăzută de legislația din Federația Rusă privind acordarea de licențe pentru anumite tipuri de activități care eliberează medicamente narcotice și medicamente psihotrope persoanelor fizice.
II. Control de calitate
3. Comerțul cu amănuntul cu produse farmaceutice se realizează prin implementarea unui set de măsuri care vizează respectarea cerințelor prezentelor Reguli și care includ (denumit în continuare sistemul calității):
a) determinarea proceselor care afectează calitatea serviciilor furnizate de o entitate de comerț cu amănuntul și care vizează satisfacerea cererii clienților pentru produse farmaceutice, obținerea de informații privind regulile de păstrare și utilizare a medicamentelor, disponibilitatea și prețul medicamentului, inclusiv primire prioritară procedura de informare cu privire la disponibilitatea medicamentelor în segmentul de preț mai mic (denumite în continuare servicii farmaceutice);
b) stabilirea succesiunii și interacțiunii proceselor necesare asigurării unui sistem de calitate, în funcție de impactul acestora asupra siguranței, eficacității și raționalității utilizării medicamentelor;
c) determinarea criteriilor și metodelor care reflectă obținerea rezultatelor, atât în implementarea proceselor necesare pentru asigurarea sistemului calității, cât și în managementul acestora, ținând cont de cerințele legislației Federației Ruse privind circulația medicamentelor; ;
d) determinarea parametrilor cantitativi și calitativi, inclusiv materiale, financiari, informaționali, de muncă, necesari menținerii proceselor sistemului calității și monitorizării acestora;
e) furnizarea populației cu produse farmaceutice de înaltă calitate, sigure, eficiente;
f) luarea măsurilor necesare pentru atingerea rezultatelor planificate și îmbunătățirea continuă a calității serviciului clienți și creșterea responsabilității personale a angajaților.
4. Documentația sistemului calității este menținută de către angajații autorizați de șeful entității de comerț cu amănuntul pe suport hârtie și (sau) electronic și include, printre altele:
a) un document privind politica și obiectivele entității de comerț cu amănuntul, care definește modalități de asigurare a cererii clienților pentru produse farmaceutice, minimizarea riscului ca medicamentele, dispozitivele medicale și suplimentele alimentare de calitate scăzută, falsificate și contrafăcute să intre în circulația publică;
b) un manual al calității care stabilește direcțiile de dezvoltare a unei entități de comerț cu amănuntul, inclusiv pentru o anumită perioadă de timp, și conține referiri la acte legislative și alte acte normative de reglementare care reglementează implementarea activităților farmaceutice;
c) documente care descriu procedura de furnizare a serviciilor farmaceutice de către o entitate de comerț cu amănuntul (denumite în continuare proceduri standard de operare);
d) ordinele și instrucțiunile conducătorului entității de comerț cu amănuntul pentru activitatea principală;
e) legitimații personale ale angajaților unei entități de comerț cu amănuntul;
f) licență pentru dreptul de a desfășura activități farmaceutice și anexe la aceasta;
g) documente referitoare la suspendarea (reluarea) vânzării produselor farmaceutice, retragerea (retragerea) medicamentelor din circulație, identificarea cazurilor de circulație a dispozitivelor medicale neînregistrate;
h) actele de inspecție ale entităților de comerț cu amănuntul de către funcționarii organelor de control (supraveghere) de stat, organelor de control municipale și auditurilor interne;
i) documente privind planificarea eficientă a activităților, implementarea proceselor de asigurare a sistemului calității și managementul acestora.
5. Documentele privind planificarea eficientă a activităților, implementarea proceselor de asigurare a sistemului calității și managementul acestora, în funcție de funcțiile implementate de entitatea de comerț cu amănuntul, includ:
a) structura organizatorica;
b) regulamentul intern al muncii;
c) un registru al prețurilor înregistrate pentru medicamentele incluse în lista medicamentelor vitale și esențiale;
d) fișe de post cu o notă de familiarizare a angajaților care ocupă posturile relevante;
e) jurnalul briefing-ului introductiv privind protecția muncii;
f) un jurnal de înregistrare a instrucțiunilor la locul de muncă;
g) jurnalul ședințelor de securitate la incendiu;
h) jurnalul de bord pentru briefing-uri privind siguranța electrică;
i) un jurnal de comenzi (instrucțiuni) pentru o entitate de comerț cu amănuntul;
j) un jurnal de înregistrare zilnică a parametrilor de temperatură și umiditate în spațiile de depozitare a medicamentelor, dispozitivelor medicale și suplimentelor alimentare;
k) un jurnal de înregistrare periodică a temperaturii din interiorul echipamentului frigorific;
l) un jurnal al tranzacțiilor aferente circulației medicamentelor incluse în lista medicamentelor supuse contabilității subiect-cantitative (dacă există);
m) jurnalul de inspecții ale unei persoane juridice, întreprinzător individual, efectuate de organele de control (supraveghere) de stat, organele de control municipal (dacă există);
o) un jurnal pentru furnizarea de medicamente incluse în gama minimă de medicamente necesară acordării de îngrijiri medicale (denumită în continuare gama minimă), dar care nu este disponibilă la momentul solicitării cumpărătorului;
o) un jurnal de prescripții scrise greșit;
p) un jurnal de bord pentru medicamente cu termen de valabilitate limitat;
c) jurnalul defectelor;
r) jurnal de ambalaje de laborator;
s) un jurnal al tranzacțiilor legate de traficul de stupefiante, substanțe psihotrope și precursorii acestora (dacă există);
t) jurnal de bord pentru înregistrarea rezultatelor controlului de recepție;
x) jurnalul de primire și consum de vaccinuri (dacă sunt disponibile);
v) un jurnal al prescripțiilor care au fost (sunt) în service amânat (dacă există);
h) un jurnal de lucru de informare cu organizațiile medicale privind procedura de furnizare gratuită a unor categorii de cetățeni cu medicamente și produse medicale, precum și vânzarea medicamentelor și a produselor medicale cu reducere.
Șeful unei entități de comerț cu amănuntul are dreptul de a aproba alte tipuri și forme de reviste.
6. Șeful unei entități de comerț cu amănuntul numește persoane responsabile cu menținerea și păstrarea documentelor enumerate la alineatele 4 și 5 din prezentul Regulament, oferind acces la acestea și, dacă este necesar, refacerea acestora.
Perioada de depozitare a acestor documente este determinată în conformitate cu cerințele legislației Federației Ruse în materie de arhivă.
III. Șeful entității de comerț cu amănuntul
7. Conducătorul unei entități de comerț cu amănuntul asigură:
a) aducerea la cunoștința angajaților prezentelor Reguli și respectarea acestora, aducând la cunoștința angajaților drepturile și responsabilitățile acestora determinate de fișele postului și standardele profesionale;
b) determinarea politicii și a obiectivelor activităților care vizează satisfacerea cererii clienților pentru produse farmaceutice, minimizarea riscurilor ca medicamentele, dispozitivele medicale și suplimentele alimentare de calitate scăzută, falsificate și contrafăcute să intre în circulația publică, precum și interacțiunea eficientă între un lucrător medical; un lucrător farmaceutic și un cumpărător;
c) reducerea pierderilor de producție, optimizarea activităților, creșterea cifrei de afaceri comerciale, creșterea nivelului de cunoștințe și calificare a lucrătorilor din domeniul farmaceutic;
d) analiza conformității cu politicile și obiectivele de afaceri, rapoartele de audit intern și inspecțiile externe în vederea îmbunătățirii serviciilor farmaceutice furnizate;
e) resursele necesare pentru funcționarea tuturor proceselor entității comerciale cu amănuntul pentru a respecta cerințele de autorizare, cerințele sanitare și epidemiologice, normele de sănătate și securitate în muncă, reglementările împotriva incendiilor și alte cerințe stabilite de legislația Federației Ruse;
f) desfăşurarea de activităţi care vizează stimularea şi motivarea activităţilor angajaţilor;
g) aprobarea procedurilor standard de operare;
h) stabilirea unei proceduri interne de schimb de informații, inclusiv de informații legate de funcționarea sistemului calității, inclusiv prin utilizarea unui formular scris (fișă de familiarizare), standuri de anunțuri în locuri publice, desfășurarea de ședințe de informare cu o anumită frecvență, distribuirea electronică a informațiilor la o adresă de e-mail;
i) disponibilitatea sistemelor informaționale care să permită efectuarea de operațiuni legate de distribuția de mărfuri și identificarea medicamentelor falsificate, contrafăcute și substandard.
8. Conducătorul unei entități de comerț cu amănuntul, în scopul asigurării unei livrări neîntrerupte de produse farmaceutice către clienți, organizează:
a) asigurarea unui sistem de achiziții care împiedică distribuirea de produse farmaceutice falsificate, substandard, contrafăcute;
b) dotarea sediului cu echipamente care să asigure manipularea corespunzătoare a produselor farmaceutice, inclusiv depozitarea, contabilitatea, vânzarea și eliberarea acestora;
d) informarea clienților cu privire la disponibilitatea mărfurilor, inclusiv a medicamentelor din segmentul de preț mai mic.
9. Conducătorul unei entități de comerț cu amănuntul aduce la cunoștința salariaților următoarele informații:
a) privind modificările aduse legislației Federației Ruse care reglementează raporturile juridice care decurg din circulația produselor farmaceutice, inclusiv modificările regulilor de eliberare a medicamentelor;
b) asupra rezultatelor auditurilor interne și externe;
c) asupra acțiunilor preventive și corective necesare pentru eliminarea (prevenirea) încălcărilor cerințelor de licențiere;
d) cu privire la rezultatele luării în considerare a reclamațiilor și sugestiilor din partea clienților.
10. Conducătorul unei entități de comerț cu amănuntul, ținând cont de cerințele legislației muncii și ale altor acte juridice de reglementare care conțin norme de drept al muncii, este desemnată persoană responsabilă cu implementarea și asigurarea sistemului calității (denumită în continuare persoana responsabilă).
11. Șeful unei entități de comerț cu amănuntul analizează sistemul calității în conformitate cu graficul aprobat de acesta.
Analiza include o evaluare a posibilității de îmbunătățiri și a necesității de schimbări în organizarea sistemului calității, inclusiv în politicile și obiectivele activităților, și se realizează prin luarea în considerare a rezultatelor auditurilor interne (inspecții), a unei cărți de recenzii și sugestii, chestionare, dorințe orale ale clienților (feedback de la cumpărător), realizări moderne ale științei și tehnologiei, articole, recenzii și alte date.
Pe baza rezultatelor analizei sistemului calității, șeful unei entități de comerț cu amănuntul poate decide cu privire la necesitatea și (sau) oportunitatea creșterii eficacității sistemului calității și a proceselor acestuia, îmbunătățirea calității serviciilor farmaceutice, schimbări în nevoia de resurse (materiale, financiare, de muncă și altele), investițiile necesare pentru îmbunătățirea serviciului clienți, sisteme de motivare a angajaților, instruire suplimentară (instruire) pentru angajați și alte soluții.
IV. Personal
12. Pentru a respecta cerințele stabilite prin prezentul Regulament, o entitate de comerț cu amănuntul, ținând cont de volumul serviciilor farmaceutice pe care le prestează, trebuie să dispună de personalul necesar.
Șeful unei entități de comerț cu amănuntul aprobă tabelul de personal, care conține o listă a diviziilor structurale, denumirea posturilor, specialități, profesii care indică calificări, informații despre numărul de unități de personal și fondul de salarii.
Fiecare angajat trebuie să fie familiarizat cu drepturile și responsabilitățile sale cuprinse în fișele postului și standardele profesionale.
13. Angajații care efectuează lucrări care afectează calitatea produsului trebuie să aibă calificările și experiența de lucru necesare pentru a respecta cerințele stabilite de prezentele Reguli.
14. Pentru angajații nou angajați, în conformitate cu reglementările locale ale entității de comerț cu amănuntul, se implementează un program de adaptare și se verifică periodic calificările, cunoștințele și experiența acestor angajați.
Programul de adaptare include, printre altele:
a) formare de inițiere la angajare;
b) instruire (instruire) la locul de muncă (inițială și repetată);
c) actualizarea cunoștințelor:
legislația Federației Ruse în domeniul circulației medicamentelor și al protecției sănătății publice, al protecției drepturilor consumatorilor;
reguli de igienă personală;
privind procedura de furnizare a serviciilor farmaceutice, inclusiv consultanță farmaceutică și utilizarea produselor medicale la domiciliu;
d) dezvoltarea abilităților de comunicare și prevenirea conflictelor;
e) instrucţiuni privind securitatea şi protecţia muncii.
15. Principalele funcții ale lucrătorilor din domeniul farmaceutic includ:
a) vânzarea de produse farmaceutice de calitate corespunzătoare;
b) furnizarea de informații fiabile despre produsele farmaceutice, costurile acestora, consultanță farmaceutică;
c) informații despre utilizarea rațională a medicamentelor în scopul automedicației responsabile;
d) producerea de medicamente conform prescripțiilor pentru medicamente și cerințelor de facturare ale organizațiilor medicale;
e) intocmirea documentatiei contabile;
f) respectarea eticii profesionale.
16. Cerințele privind calificările și experiența de muncă a conducătorului unei entități de comerț cu amănuntul și a lucrătorilor acesteia din domeniul farmaceutic sunt stabilite prin Regulamentul privind autorizarea activităților farmaceutice.<1>.
<1>Decretul Guvernului Federației Ruse din 22 decembrie 2011 N 1081 „Cu privire la autorizarea activităților farmaceutice” (Legislația colectată 2012, N 1, art. 126; 2012, N 37, art. 5002; 2013, N 16, art. 1970; 2016, N 40, art. 5738).
17. Conducătorul unei entități de comerț cu amănuntul se asigură că pregătirea (instruirea) inițială și ulterioară a salariaților asupra următoarelor aspecte se desfășoară conform programului aprobat de acesta:
a) reguli de eliberare a medicamentelor de uz medical;
b) reguli de eliberare a stupefiantelor și substanțelor psihotrope înregistrate ca medicamente, medicamentelor care conțin stupefiante și substanțe psihotrope;
c) reguli de eliberare a medicamentelor supuse contabilității subiect-cantitative, reguli de ținere a unui jurnal al medicamentelor supuse contabilității subiect-cantitative;
d) reguli de eliberare a medicamentelor care conțin cantități mici de stupefiante;
e) procedura de pastrare a retetelor;
f) respectarea cerințelor de disponibilitate a unui sortiment minim;
g) respectarea cerințelor de bună practică pentru depozitarea și transportul medicamentelor;
h) aplicarea sumelor maxime stabilite de majorări cu amănuntul la prețurile efective de vânzare ale producătorilor pentru medicamentele incluse în lista medicamentelor vitale și esențiale, procedura de stabilire a prețurilor la astfel de medicamente;
i) respectarea cerințelor pentru lucrul cu produse farmaceutice falsificate, de calitate scăzută, contrafăcute;
j) respectarea restricțiilor impuse lucrătorilor din domeniul farmaceutic atunci când își desfășoară activitățile profesionale;
k) îmbunătățirea cunoștințelor despre medicamente, inclusiv medicamentele generice, medicamentele interschimbabile, capacitatea de a oferi informații comparative despre medicamente și prețuri, inclusiv medicamentele din segmentul de preț mai mic, despre medicamente noi, forme de dozare ale medicamentelor, indicații de utilizare a medicamentelor;
l) metode de prelucrare a datelor primite de la cumpărători cu privire la aspecte legate de utilizarea medicamentelor identificate în timpul utilizării, efectele secundare, precum și de comunicare a acestor informații către părțile interesate;
m) respectarea cerințelor de protecție a muncii.
V. Infrastructură
18. Conducătorul unei entități de comerț cu amănuntul asigură și menține în stare de funcționare infrastructura necesară îndeplinirii cerințelor de autorizare pentru desfășurarea activităților farmaceutice, care include:
a) clădiri, spațiu de lucru și echipamente de lucru asociate;
b) echipamente pentru procese (hardware si software);
c) servicii suport (transport, comunicatii si sisteme informatice).
19. Spațiile și echipamentele trebuie amplasate, echipate și exploatate în așa fel încât să fie adecvate funcțiilor îndeplinite. Dispunerea și designul acestora ar trebui să minimizeze riscul de erori și să permită curățarea și întreținerea eficientă pentru a preveni acumularea de praf sau murdărie și orice factori care ar putea avea un efect negativ asupra calității produselor farmaceutice.
20. Toate spațiile unei entități de comerț cu amănuntul trebuie să fie situate într-o clădire (structură) și combinate funcțional, izolate de alte organizații și să asigure absența accesului neautorizat în incintă de către persoane neautorizate. Este permisă intrarea (ieșirea) pe teritoriul unei entități de comerț cu amănuntul prin sediul unei alte organizații.
21. O entitate de comerț cu amănuntul trebuie să prevadă posibilitatea de a aranja intrarea și ieșirea nestingherite pentru persoanele cu dizabilități în conformitate cu cerințele legislației privind protecția persoanelor cu dizabilități.
În cazul în care caracteristica de proiectare a clădirii nu permite amenajarea intrării și ieșirii pentru persoanele cu dizabilități, entitatea de comerț cu amănuntul trebuie să organizeze posibilitatea apelării unui farmacist pentru a deservi aceste persoane.
22. O entitate de comerț cu amănuntul trebuie să aibă un semn care să indice:
a) tipul de organizație de farmacie în limba rusă și în limbile naționale: „Farmacie” sau „Punctul de farmacie” sau „Chioșc de farmacie”;
b) denumirea completă și (dacă există) prescurtată, inclusiv denumirea companiei și forma organizatorică și juridică a entității comerciale cu amănuntul;
c) modul de operare.
O entitate de comerț cu amănuntul care vinde produse farmaceutice pe timp de noapte trebuie să aibă un panou iluminat cu informații despre lucrul pe timp de noapte.
Atunci când o entitate comercială cu amănuntul este situată în interiorul unei clădiri, semnul trebuie să fie amplasat pe peretele exterior al clădirii; dacă acest lucru nu este posibil, este permisă instalarea unui semn, ale cărui cerințe sunt similare cu cerințele pentru un semn. .
23. Spațiile trebuie să respecte standardele și cerințele sanitare și igienice și să asigure capacitatea de a îndeplini principalele funcții ale unei entități de comerț cu amănuntul în conformitate cu cerințele aprobate prin prezentele Reguli.
24. Suprafața spațiilor utilizate de o entitate de comerț cu amănuntul trebuie împărțită în zone destinate îndeplinirii următoarelor funcții:
a) comerțul cu produse farmaceutice cu asigurarea unor spații de depozitare care nu permit accesul gratuit al cumpărătorilor la bunurile vândute, inclusiv la cele cu rețetă;
b) acceptarea produselor farmaceutice, zona de depozitare de carantină, inclusiv separat pentru medicamente;
c) depozitarea separată a îmbrăcămintei lucrătorilor.
Dacă o entitate de comerț cu amănuntul este situată într-o clădire împreună cu alte organizații, este permisă folosirea în comun a băii.
25. Prezența altor zone și (sau) spații în incinta unei entități de comerț cu amănuntul este determinată de conducătorul entității de comerț cu amănuntul, în funcție de volumul de muncă prestat și de serviciile prestate.
26. Sediul unei entități comerciale cu amănuntul trebuie să fie echipat cu sisteme de încălzire și aer condiționat (dacă există), ventilație naturală sau forțată (dacă există), asigurând condiții de muncă în conformitate cu legislația muncii a Federației Ruse, precum și ca respectarea cerințelor de bună practică pentru depozitarea și transportul medicamentelor medicamente.
27. Materialele utilizate la finisarea și (sau) repararea spațiilor (zonelor) trebuie să respecte cerințele de siguranță la incendiu stabilite de legislația Federației Ruse.
Spațiile unei entități comerciale cu amănuntul trebuie să fie proiectate și echipate astfel încât să asigure protecție împotriva pătrunderii insectelor, rozătoarelor sau altor animale.
În sediul unei entități de comerț cu amănuntul destinat fabricării de medicamente, suprafețele pereților și tavanelor trebuie să fie netede, fără a compromite integritatea stratului de acoperire (vopsele impermeabile, emailuri sau plăci smălțuite deschise), finisate cu materiale care permite curatarea umeda folosind dezinfectanti (placi ceramice neglazuite, linoleum cu sudura obligatorie a cusăturilor sau a altor materiale).
Joncțiunea pereților cu tavanul și podeaua nu trebuie să aibă adâncituri, proeminențe sau cornișe.
28. Sediul unei entități de comerț cu amănuntul poate avea atât iluminat natural, cât și artificial. Iluminatul artificial general trebuie asigurat în toate încăperile; pentru locurile de muncă individuale, dacă este necesar, se asigură iluminat artificial local.
29. O entitate de comerț cu amănuntul trebuie să aibă echipamente și inventar care să asigure păstrarea calității, eficienței și siguranței produselor farmaceutice.
30. Spațiile pentru depozitarea medicamentelor trebuie să fie dotate cu echipamente care să permită depozitarea acestora, ținând cont de cerințele de bună practică pentru depozitarea și transportul medicamentelor.
Spațiile, precum și echipamentele utilizate de o entitate comercială cu amănuntul atunci când desfășoară activități, trebuie să îndeplinească cerințele sanitare de securitate la incendiu, precum și reglementările de siguranță în conformitate cu legislația Federației Ruse.
31. Echipamentele trebuie instalate la o distanta de minim 0,5 metri fata de pereti sau alte echipamente pentru a avea acces pentru curatare, dezinfectare, reparare, intretinere, verificare si (sau) calibrare a echipamentelor, pentru a asigura accesul la produse farmaceutice, gratuit. muncitori de trecere.
Echipamentul nu trebuie să blocheze sursele de lumină naturală sau artificială sau să obstrucționeze căile de trecere.
32. Doar persoanele autorizate de șeful entității de comerț cu amănuntul ar trebui să aibă acces în spații (zone). Accesul persoanelor neautorizate în aceste spații este interzis.
33. Echipamentele utilizate de o entitate comercială cu amănuntul trebuie să aibă pașapoarte tehnice care se păstrează pe toată perioada de funcționare a echipamentului.
Echipamentele utilizate de o entitate comercială cu amănuntul și aferente instrumentelor de măsurare, înainte de punere în funcțiune, precum și după reparații și (sau) întreținere, sunt supuse verificării și (sau) calibrării inițiale, iar în timpul funcționării - verificare periodică și (sau) calibrare în în conformitate cu cerințele legislației Federației Ruse pentru a asigura uniformitatea măsurătorilor.
34. Sediul și (sau) zona de vânzare cu amănuntul trebuie să fie dotate cu vitrine, rafturi (gondole) - cu expoziție deschisă a mărfurilor, oferind o imagine de ansamblu asupra produselor farmaceutice permise spre vânzare, precum și asigurarea ușurinței de utilizare pentru angajații din entitate de comerț cu amănuntul.
Este permisă expunerea deschisă a medicamentelor fără prescripție medicală și a altor produse farmaceutice.
35. Informațiile despre medicamentele eliberate fără prescripție medicală pot fi plasate pe raft sub formă de afiș, vobbler și alte medii de informare pentru a oferi cumpărătorului posibilitatea de a alege în cunoștință de cauză un produs de farmacie, de a obține informații despre producătorului, modul de utilizare a acestuia și în scopul păstrării tipului extern de produs. De asemenea, într-un loc convenabil pentru vizualizare, trebuie plasată o etichetă de preț care să indice numele, doza, numărul de doze din ambalaj, țara de origine, data de expirare (dacă este disponibilă).
36. Medicamentele vândute fără prescripție medicală se așează pe vitrine ținând cont de condițiile de păstrare prevăzute în instrucțiunile de uz medical și (sau) pe ambalaj.
Medicamentele eliberate pe bază de rețetă pot fi păstrate în vitrine, în vitrine și dulapuri deschise, cu condiția ca clienții să nu aibă acces la ele.
Produsele medicamentoase eliberate pe bază de rețetă sunt găzduite separat de produsele medicamentoase fără prescripție medicală, în dulapuri încuiate, cu „medicamentul eliberat pe bază de rețetă” marcat pe raftul sau dulapul în care sunt depozitate astfel de medicamente.
VI. Procesele de activitate ale unui subiect de comerț cu amănuntul cu produse farmaceutice
37. Toate procesele unei entități de comerț cu amănuntul care afectează calitatea, eficiența și siguranța produselor farmaceutice sunt efectuate în conformitate cu procedurile standard de operare aprobate.
38. Șeful unei organizații de farmacie, întreprinzător individual deținător de licență pentru activități farmaceutice, asigură disponibilitatea unui sortiment minim.
39. Șeful unei entități de comerț cu amănuntul trebuie să monitorizeze parametrii cantitativi și calitativi ai produselor farmaceutice achiziționate, precum și datele de livrare a acestora în conformitate cu contractele încheiate în conformitate cu cerințele legislației Federației Ruse.
40. Conducătorul unei entități de comerț cu amănuntul trebuie să aprobe procedura de selectare și evaluare a furnizorilor de produse farmaceutice, ținând seama, printre altele, de următoarele criterii:
a) conformitatea furnizorului cu cerințele legislației actuale a Federației Ruse privind acordarea de licențe pentru anumite tipuri de activități;
b) reputația de afaceri a furnizorului pe piața farmaceutică, pe baza prezenței faptelor de rechemare a produselor farmaceutice falsificate, substandard, contrafăcute, a neîndeplinirii obligațiilor contractuale acceptate, a ordinelor organelor de control de stat autorizate cu privire la fapte de încălcare a cerințelor; a legislației Federației Ruse;
c) cererea de produse farmaceutice oferite de furnizor pentru vânzare ulterioară, conformitatea calității produselor farmaceutice cu cerințele legislației Federației Ruse;
d) respectarea de către furnizor a cerințelor stabilite prin prezentul Regulament pentru întocmirea documentației, disponibilitatea unui document cu o listă de declarații de conformitate a produsului cu cerințele stabilite, un protocol pentru convenirea prețurilor la medicamentele incluse în lista de medicamente vitale și esențiale;
e) respectarea de către furnizor a condițiilor de temperatură în timpul transportului medicamentelor termolabile, inclusiv medicamentelor imunobiologice;
f) furnizarea de către furnizor a unei garanții de calitate pentru produsele farmaceutice furnizate;
g) competitivitatea clauzelor contractuale oferite de furnizor;
h) fezabilitatea economică a termenelor de livrare a mărfurilor propuse de furnizor (număr de colete furnizate, cantitate minimă de livrare);
i) capacitatea de a furniza o gamă largă;
j) respectarea termenului de livrare cu timpul de lucru al entității de comerț cu amănuntul.
41. Entitatea comercială cu amănuntul și furnizorul încheie un acord luând în considerare cerințele legislației privind fundamentele reglementării de stat a activităților comerciale în Federația Rusă, precum și luând în considerare cerințele legislației civile, care prevăd: termenul limită pentru care furnizorul să accepte o revendicare privind calitatea produsului, precum și posibilitatea de a returna furnizorului sortiment de produse farmaceutice falsificate, de calitate scăzută, contrafăcute, dacă informațiile despre aceasta au fost primite după acceptarea mărfurilor și executarea procedurii relevante. documente.
42. În ceea ce privește produsele farmaceutice (cu excepția produselor medicale), unei entități de comerț cu amănuntul i se permite să furnizeze furnizorului servicii pe bază de rambursare, al căror obiect este realizarea acțiunilor care sunt benefice din punct de vedere economic pentru furnizor și contribuie la creșterea vânzărilor. a produselor farmaceutice (cu excepția produselor medicale) și fidelizarea clienților.
Furnizorul decide în mod independent dacă trebuie să achiziționeze astfel de servicii, iar impunerea unor astfel de servicii furnizorului de către o entitate de comerț cu amănuntul nu este permisă.
43. Achiziționarea de produse farmaceutice de către o entitate de comerț cu amănuntul creată sub forma unei întreprinderi unitare de stat și municipale se realizează în conformitate cu cerințele legislației Federației Ruse privind sistemul contractual în domeniul achizițiilor de bunuri, lucrări, servicii pentru satisfacerea nevoilor de stat și municipale.
44. În procesul de acceptare a mărfurilor farmaceutice, inclusiv a celor care necesită condiții speciale de depozitare și măsuri de siguranță, conformitatea mărfurilor acceptate cu documentația de expediere în ceea ce privește sortimentul, cantitatea și calitatea, respectarea condițiilor speciale de depozitare (dacă există o astfel de cerință), precum și verificarea deteriorării se efectuează containerul de transport.
Competența unei entități de comerț cu amănuntul de a verifica calitatea produselor farmaceutice furnizate este limitată la o inspecție vizuală a aspectului, verificarea conformității cu documentele însoțitoare, a caracterului complet al setului de documente însoțitoare, inclusiv registrul documentelor care confirmă calitatea produselor farmaceutice. . O entitate de comerț cu amănuntul trebuie să țină cont de specificul acceptării și inspecției înainte de vânzare a produselor farmaceutice.
45. Recepția produselor farmaceutice se efectuează de către o persoană responsabilă financiar. Dacă produsele farmaceutice sunt în containere de transport fără deteriorare, atunci acceptarea poate fi efectuată după numărul de locuri sau după numărul de unități de produs și marcajele de pe container. Dacă nu se verifică disponibilitatea reală a produselor farmaceutice în containere, atunci este necesar să se noteze acest lucru în documentul de însoțire.
46. În cazul în care cantitatea și calitatea produselor farmaceutice corespund cu cele specificate în documentele însoțitoare, atunci pe documentele însoțitoare se aplică o ștampilă de acceptare (avis de parcurs, factură, scrisoare de parcurs, registru documente de calitate și alte documente care atestă cantitatea sau calitatea). de mărfuri primite), confirmând faptul că produsele farmaceutice acceptate respectă datele specificate în documentele însoțitoare. Persoana responsabilă financiar care acceptă produse farmaceutice își pune semnătura pe documentele însoțitoare și o certifică cu sigiliul entității de comerț cu amănuntul (dacă există).
47. În cazul unei neconcordanțe între produsele farmaceutice furnizate unei entități de comerț cu amănuntul și condițiile contractului, documentele însoțitoare, comisia entității de comerț cu amănuntul, în conformitate cu procedura standard de operare aprobată, întocmește un act. , care stă la baza depunerii reclamațiilor la furnizor (întocmirea unilaterală a unui act de către persoana responsabilă financiar este posibilă dacă acordul furnizorului sau absența reprezentantului acestuia).
Entitatea comercială cu amănuntul, de comun acord cu furnizorul, poate aproba o altă metodă de notificare a furnizorului cu privire la neconformitatea produselor farmaceutice furnizate cu documentele însoțitoare.
48. Produsele medicamentoase, indiferent de sursa de aprovizionare, sunt supuse controlului de acceptare pentru a preveni intrarea pe piață a medicamentelor contrafăcute, substandard și contrafăcute.
Controlul acceptării constă în verificarea produselor medicamentoase primite prin evaluarea:
a) aspect, culoare, miros;
b) integritatea ambalajului;
c) conformitatea etichetării medicamentelor cu cerințele stabilite de legislația privind circulația medicamentelor;
d) executarea corectă a documentelor însoțitoare;
e) prezența unui registru de declarații care confirmă calitatea medicamentelor în conformitate cu documentele de reglementare în vigoare.
49. Pentru efectuarea controlului de recepție se creează, prin ordin al conducătorului entității de comerț cu amănuntul, un comitet de recepție. Membrii comisiei trebuie să cunoască toate actele legislative și alte acte normative ale Federației Ruse care definesc cerințele de bază pentru produsele farmaceutice, execuția documentelor însoțitoare și caracterul complet al acestora.
50. Înainte de a fi livrate în zona de vânzare, produsele farmaceutice trebuie să fie supuse pregătirii înainte de vânzare, care include despachetarea, sortarea și inspecția, verificarea calității produsului (prin semne externe) și disponibilitatea informațiilor necesare despre produs și despre acesta. furnizor.
51. Produsele alimentare medicale, pentru bebeluși și dietetice, aditivii biologic activi sunt produse alimentare care, înainte de a fi furnizate într-o zonă comercială sau alt loc de comerț, trebuie eliberate de recipiente, materiale de ambalare și legare și cleme metalice. Entitatea de comerț cu amănuntul trebuie, de asemenea, să verifice calitatea produselor alimentare medicale, pentru bebeluși și dietetice, a suplimentelor alimentare pe baza semnelor externe, să verifice disponibilitatea documentației și informațiilor necesare și să efectueze respingerea și sortarea.
Comerțul cu produse alimentare medicale, pentru copii și dietetice, aditivi biologic activi este interzis dacă integritatea ambalajului este încălcată. Calitatea acestui grup de mărfuri este confirmată printr-un certificat de înregistrare de stat, care indică domeniul de aplicare și utilizare, și un document de la producător și (sau) furnizor care confirmă siguranța produsului - o declarație de conformitate a calității sau o registrul declaratiilor.
În cazul încălcării integrității ambalajului sau lipsei unui pachet complet de documente, produse alimentare medicale, pentru bebeluși și dietetice, suplimentele alimentare trebuie returnate furnizorului.
52. Dezinfectanții, înainte de a fi furnizați în zona de vânzare sau plasați la punctul de vânzare, trebuie să fie supuși pregătirii înainte de vânzare, care include scoaterea din containerele de transport, sortarea, verificarea integrității ambalajului (inclusiv funcționarea ambalajului cu aerosoli) și calitatea produsului prin semne externe, disponibilitatea informațiilor necesare despre dezinfectanți și producătorul acestuia, instrucțiuni de utilizare.
Parfumurile și produsele cosmetice furnizate zonei comerciale trebuie să respecte cerințele stabilite prin Decizia Comisiei Uniunii Vamale din 23 septembrie 2011 N 799 „Cu privire la adoptarea reglementărilor tehnice ale Uniunii Vamale „Cu privire la siguranța parfumurilor și cosmeticelor”. produse".
VII. Vânzări de produse farmaceutice
53. Comerțul cu amănuntul cu produse farmaceutice include vânzări, distribuție și consultanță farmaceutică.
Pentru a oferi servicii de consultanță farmaceutică, este permisă alocarea unei zone speciale, inclusiv pentru așteptarea consumatorilor, cu instalarea sau desemnarea limitatoarelor speciale și organizarea locurilor.
54. La vânzarea medicamentelor, un lucrător farmaceutic nu are dreptul să ascundă cumpărătorului informații despre disponibilitatea altor medicamente care au aceeași denumire comună internațională și prețurile acestora în raport cu cel solicitat.
55. În zona comercială, într-un loc convenabil pentru vizionare, se află următoarele:
a) o copie a licenței pentru activități farmaceutice;
b) o copie a licenței pentru traficul de stupefiante, substanțe psihotrope și precursori ai acestora, cultivarea plantelor stupefiante (dacă există);
c) informații despre imposibilitatea returnării și schimbului de produse farmaceutice de calitate corespunzătoare;
d) alte documente si informatii care trebuie aduse la cunostinta cumparatorilor.
56. La cererea cumpărătorului, lucrătorul farmaceutic trebuie să-l familiarizeze cu documentația de însoțire a produsului, care să conțină pentru fiecare denumire de produs informații privind confirmarea obligatorie a conformității în conformitate cu legislația Federației Ruse privind reglementările tehnice (certificatul de conformitate, numărul, perioada de valabilitate a acestuia, organismul care a emis certificatul sau informații despre declarația de conformitate, inclusiv numărul acesteia de înregistrare, perioada de valabilitate a acesteia, numele persoanei care a acceptat declarația și organismul care a înregistrat-o). Aceste documente trebuie certificate prin semnătura și sigiliul (dacă există) furnizorului sau vânzătorului, indicând adresa locației acestuia și numărul de telefon de contact.
57. Comerțul cu amănuntul cu produse farmaceutice care nu au legătură cu medicamente poate fi efectuat de angajați care nu au studii farmaceutice sau studii profesionale suplimentare în comerțul cu amănuntul al medicamentelor dacă lucrează în secții separate (ambulatori, paramedic și paramedic-). posturi obstetricale, centre (secții) de medicină generală (de familie) organizații medicale autorizate să desfășoare activități farmaceutice și situate în mediul rural unde nu există farmacii.
58. Fiecare entitate de comerț cu amănuntul trebuie să aibă o carte de recenzii și sugestii, care este furnizată cumpărătorului la cererea acestuia.
VIII. Efectuarea evaluărilor de performanță
59. Conducătorul unei entități de comerț cu amănuntul efectuează o evaluare a activităților pentru a verifica caracterul complet al conformității cu cerințele stabilite prin prezentele Reguli și pentru a determina acțiuni corective.
60. Probleme legate de personal, sedii, echipamente, documentație, respectarea regulilor comerțului cu produse farmaceutice, măsuri de lucru cu recenzii și sugestii ale clienților, munca de identificare a produselor farmaceutice contrafăcute, substandard, contrafăcute, precum și activități de desfășurare internă auditurile ar trebui analizate de șeful entității de comerț cu amănuntul în conformitate cu graficul aprobat.
61. Auditul intern trebuie efectuat în mod independent și cu atenție de către persoane special desemnate de șeful entității de comerț cu amănuntul, care fac parte din personalul entității de comerț cu amănuntul și (sau) sunt angajate pe bază de contract.
Prin decizia conducătorului unei entități de comerț cu amănuntul, poate fi efectuat un audit independent, inclusiv de către experți de la entități terțe de comerț cu amănuntul.
62. Rezultatele auditului intern sunt documentate.
Documentele întocmite în urma auditului trebuie să cuprindă toate informațiile obținute și propunerile de acțiuni corective necesare.
Măsurile luate pe baza rezultatelor auditului intern sunt, de asemenea, documentate.
63. Auditul intern se efectuează, de asemenea, cu scopul de a identifica deficiențe în conformitate cu cerințele legislației Federației Ruse și de a face recomandări pentru acțiuni corective și preventive.
64. Programul de audit intern ar trebui să țină seama de rezultatele auditurilor și inspecțiilor interne anterioare efectuate de autoritățile de reglementare.
65. Persoana responsabilă cu aria de activitate a entității de comerț cu amănuntul inspectată trebuie să se asigure că sunt întreprinse imediat măsuri corective și preventive.
Acțiunile ulterioare ar trebui să includă un audit al acțiunilor corective și preventive întreprinse și un raport privind rezultatele acțiunilor întreprinse și eficacitatea acestora.
66. Conducătorul unei entități de comerț cu amănuntul trebuie să asigure identificarea produselor farmaceutice care nu îndeplinesc cerințele documentației de reglementare pentru a preveni utilizarea sau vânzarea neintenționată a acestora.
Produsele farmaceutice falsificate, substandard, contrafăcute trebuie identificate și izolate de alte produse farmaceutice în conformitate cu procedurile standard de operare.
Etichetarea, amplasarea și metodele de delimitare a unei zone de carantină, precum și persoana responsabilă cu lucrul cu produsele farmaceutice specificate, se stabilesc prin ordin al conducătorului unității de comerț cu amănuntul.
67. Șeful unei entități de comerț cu amănuntul trebuie să îmbunătățească constant eficacitatea sistemului calității, folosind, printre altele, rezultatele auditului intern, analizei datelor, acțiunilor corective și preventive.
68. Procedurile standard de operare ar trebui să descrie cum să:
a) analiza reclamațiilor și sugestiilor clienților și luarea deciziilor cu privire la acestea;
b) stabilirea motivelor de încălcare a cerințelor prezentului Regulament și a altor cerințe ale actelor juridice de reglementare care reglementează circulația produselor farmaceutice;
c) evaluarea necesității și oportunității luării măsurilor adecvate pentru a evita reapariția unei încălcări similare;
d) identificarea și implementarea acțiunilor necesare pentru a preveni ca produsele farmaceutice contrafăcute, substandard, contrafăcute să ajungă la cumpărător;
e) analizarea eficacității acțiunilor preventive și corective întreprinse.
Cele mai recente materiale de site
Alimente

Tranzacționează conspirații care trebuie citite în fiecare zi
În imaginația populară, folosirea magiei este asociată în principal cu dragostea, ura și alte pasiuni. Cu toate acestea, în realitate, magia este adesea folosită nu numai pentru a vrăji pe cineva sau pentru a se răzbuna pe cineva, ci și pentru a rezolva probleme destul de practice.
Revistă

Ce este o companie offshore și cum să o recunoaștem?
Aproape toți am auzit despre existența unor astfel de companii offshore, dar nu toată lumea înțelege sensul acestui termen. Ce sunt companiile offshore din punct de vedere economic? Acestea sunt centre financiare care atrag capital străin prin furnizare
Îngrijire și divertisment
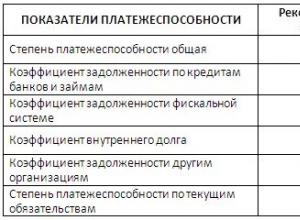
Analiza financiară a unui exemplu de întreprindere
La întocmirea unui plan de afaceri, este necesar să se analizeze indicatorii stării financiare a organizației care implementează proiectul de investiții. Dacă proiectul implică crearea unei noi organizații, atunci această etapă este ratată în etapa inițială și
Recreere și divertisment
Programul și programul de lucru: toate principiile organizării corecte a rutinelor de lucru
Programul de lucru pentru anul 2019 este un document multicomponent care informează despre următoarele: programul de lucru standard; numărul de weekenduri și zile lucrătoare; limitele și durata zilei de lucru; combinarea perioadelor de lucru cu perioadele de odihnă
Îngrijire și divertisment

Opțiuni și procedură de concediere în timpul concediului medical
Puteți demisiona în concediu medical doar din proprie inițiativă. Dacă concedierea în concediu medical are loc prin decizie a angajatorului (pe bază de absenteism pe motiv de boală, concediere din cauza reducerii personalului etc.), acțiunile acestuia sunt ilegale.
Idei de acasă

Sancțiuni disciplinare: porunci pentru ofițerii de cadre Rezolvă problema tragerii răspunderii disciplinare
Aducerea salariatului la răspundere disciplinară: schema Procedura de aducere a salariaților la răspundere disciplinară este reglementată de art. 193 din Codul Muncii al Federației Ruse (denumit în continuare Codul Muncii al Federației Ruse). Detaliile sunt dezvăluite pe site-ul nostru în articolele: De la ce vârstă
